-
下列对化学反应的认识错误的是 ( )
A.有化学键破坏的一定是化学反应 B.会产生新的物质
C.可能会引起物质状态的变化 D.一定伴随着能量的变化
难度: 简单查看答案及解析
-
在
2A+B
3C+4D反应中,表示该反应速率最快的是 ( )
A.v(A)=0.5 mol•L﹣1•s﹣1 B.v(B)=0.5 mol•L﹣1•s﹣1
C.v(C)=0.8 mol•L﹣1•s﹣1 D.v(D)=60 mol•L﹣1•min﹣1
难度: 简单查看答案及解析
-
下列过程或现象与盐类水解无关的是 ( )
A.纯碱溶液去油污
B.铁在潮湿的环境下生锈
C.加热氯化铁溶液颜色变深 D.浓硫化钠溶液有臭味
难度: 简单查看答案及解析
-
镍镉(Ni﹣Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd(OH)2+2Ni(OH)2
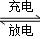 Cd+2NiO(OH)+2H2O由此可知,该电池放电时的负极材料是 ( )
Cd+2NiO(OH)+2H2O由此可知,该电池放电时的负极材料是 ( )A.Cd(OH)2 B.Ni(OH)2 C.Cd D.NiO(OH)
难度: 简单查看答案及解析
-
25℃和1.01×105Pa时,2N2O5(g)
4NO2(g)+O2(g) △H=+56.7 kJ/mol,其自发进行的原因是( )
A.反应是放热反应 B.反应是吸热反应
C.熵增大效应大于能量效应 D.是熵减小的反应
难度: 简单查看答案及解析
-
升高温度能加快化学反应速率的主要原因是( )
A.增加活化分子百分数 B.降低活化分子的能量
C.活化分子能量明显增加 D.降低反应所需的能量
难度: 简单查看答案及解析
-
下列说法中,可以说明恒容密闭容器中的反应:P(g)+Q(g)
R(g)+S(g)在恒温下已达平衡状态的是 ( )
A.反应容器内压强不随时间变化
B. P和S的生成速率相等
C.反应容器内P、Q、R、S四者物质的量浓度为1:1:1:1
D.反应容器内总物质的量不随时间而变化
难度: 简单查看答案及解析
-
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH﹣4e﹣+H2O═CH3COOH+4H+.下列有关说法正确的是( )
A.检测时,电解质溶液中的H+向负极移动
B.若有0.4mol电子转移,则在标准状况下消耗4.48 L氧气
C.电池反应的化学方程式为:CH3CH2OH+O2═CH3COOH+H2O
D.正极上发生的反应为:O2+4e﹣+2H2O═OH﹣
难度: 简单查看答案及解析
-
向纯水中加入少量NaHSO4,在温度不变时,溶液中 ( )
A.c(H+)/c(OH-)增大 B.c(H+)减小
C.水中c(H+)与c(OH-)的乘积增大 D.c(OH-)增大
难度: 简单查看答案及解析
-
下列说
法正确的是( )
A. 用润湿的pH试纸测定稀碱溶液的pH,测定值偏小
B. 用碱式滴定管量取22.00mL的KMnO4溶液
C. 在未知液中滴加
BaCl2溶液产生白色沉淀,加稀硝酸,沉淀不溶解,说明该未知液中一定含有SO42-或SO32-
D. 实验室制备氢氧化铁胶体的方法是将氢氧化钠稀溶液滴入饱和氯化铁溶液中
难度: 简单查看答案及解析
-
在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质的固体的是( )
A. 氯化铝 B. 碳酸氢钠 C. 硫酸镁 D. 高锰酸钾
难度: 简单查看答案及解析
-
有关热化学方程式书写与对应表述均正确的是( )
A.已知2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1, 则可知C的标准燃烧热为110.5 kJ·mol-1
B.在101KPa下氢气的标准燃烧热△H =-285.5 kJ·mol-1,
则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g) △H = +285.5 kJ·mol-1
C.稀硫酸与0.1 mol/LNaOH溶液反应:H+(aq)+OH-(aq) = H2O(l) △H = -57.3 kJ·mol-1
D.密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量。则Fe(s)+S(g)=FeS(s) △H= - 95.6 kJ·mol-1
难度: 中等查看答案及解析
-
常温下,下列溶液中的微粒浓度关系正确的是( )
A.新制氯水中加入固体NaOH:c(Na+)=c(Cl﹣)+c(ClO﹣)+c(OH﹣)
B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3﹣)>c(CO32﹣)>c(H2CO3)
C.pH=11的氨水与pH=3的盐酸等体积混合:c(Cl﹣)=c(NH4+)>c(OH﹣)=c(H+)
D.0.4mol•L﹣1CH3COOH溶液与0.2mol•L﹣1NaOH溶液等体积混合:2c(H+)﹣2c(OH﹣)=c(CH3COO﹣)﹣c(CH3COOH)
难度: 简单查看答案及解析
-
常温下,某未知溶液中
=1×1012,且含有大量Al3+和NO3﹣,检验此溶液中是否大量存在以下6种离子:①SiO32﹣、②NH4+、③Fe2+、④Na+、⑤HCO3﹣、⑥Cl﹣,其中不必检 验就能加以否定的离子是 ( )
A.①③⑤ B.②③④ C.①②⑥ D.④⑤⑥
难度: 困难查看答案及解析
-
为探究外界条件对反应:mA(g)+nB(g)⇌cZ(g
)△H的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数.实验结果如图所示,下列判断正确的是( )
A.△H>0
B.升温,正、逆反应速率都增大,平衡常数减小
C.增大压强,Z的含量减小
D.在恒温恒容下,向已达到平衡的体系中加入少量Z,达到平衡后Z的含量减小
难度: 困难查看答案及解析
-
室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如下图所示。下列说法正确的是( )
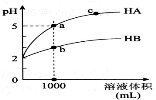
A.HA的酸性比HB的酸性弱
B.a点溶液的导电性比c点溶液的导电性弱
C.若两溶液无限稀释,则它们的c(H+)相等
D.对a、b两点溶液同时升高温度,则
增大
难度: 简单查看答案及解析
-
在一定温度下,将气体X和气体Y 各0.16 mol充入10 L 恒容密闭容器中,发生反应
X(g)+ Y(g)
2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表。下列说法正确的是 ( )
t / min
2
4
7
9
n(Y)/mol
0.12
0.11
0.10
0.10
A.反应前2min的平均速率v(Z)=2.0×10-5 mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
难度: 简单查看答案及解析
-
在容积一定的密闭容器中,反应A2(g)+B2(g)
xC(g),符合图Ⅰ所示关系。对图Ⅱ的说法正确的是(T为温度、P为压强、t为时间) ( )

A.P3<P4,y为A2转化率
B.P3<P4,y为A2浓度
C.P3>P4,y为混合气密度
D.P3>P4,y为C的体积分数
难度: 困难查看答案及解析
-
已知T℃时AgCl的Ksp=2×10-10;Ag2CrO4是一种橙红色固体,T℃时在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )

A.T℃时Ag2CrO4的Ksp=2×10-12
B.浓度均为2×10-5mol/LAgNO3溶液与NaCl溶液等体积混合没有沉淀生成
C.在饱和Ag2CrO4溶液中加入K2CrO4固体可使溶液由Y点到X点
D.保持温度T℃不变,Ag2CrO4溶液长时间放置可使溶液由X点到Z点
难度: 简单查看答案及解析
-
下述实验不能达到预期目的是( )
编号
实验内容
实验目的
A
取两支试管,分别加入4mL0.01mol/LKMnO4酸性溶液,然后向一只试管加入2mL0.1mol/LH2C2O4溶液,向另一支试管加入2mL0.2mol/LH2C2O4溶液,记录褪色时间。
验证草酸浓度越大,反应速率越快
B
向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液颜色变浅。
验证Na2CO3溶液中存在水解平衡
C
向1mL0.1mol/LMgCl2溶液中滴入2滴2mol/LNaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀。
验证相同温度下的Ksp:Mg(OH)2>Fe(OH)3
D
测定相同浓度的Na2SO3与Na2CO3溶液的pH,后者较大。
验证非金属性:
S>C
难度: 困难查看答案及解析


