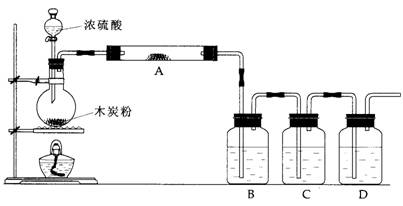
-
自道尔顿提出原子学说,关于原子理论方面的研究迅速发展。下例有关原子的叙述正确的是( )
A、同种元素的原子中,质子的数与中子的数可以不相等
B、原子里电子带负电荷,中子带正电荷,且原子是呈电中性的
C、原子都是由质子、中子和电子构成的
D、元素的化学性主要由其原子中质子数决定
难度: 中等查看答案及解析
-
13C—NMR(核磁共振)、15N—NMR是用于测定蛋白质、核酸等生物大分子的空间结构的有效手段。从事此项研究的科学家因而获得2002年诺贝尔化学奖。下面有关13C、15N叙述正确的是 ( )
A.、13C与15N有相同的中子数 B.、15N与14N互为同位素
C.、13C与C60互为同素异形体 D.、15N的核外电子数与中子数相同
难度: 简单查看答案及解析
-
下列各组原子序数所表示的两种元素,能形成A2B3型离子化合物的是( )
A、7和8 B、8和13 C、11和16 D、2和17
难度: 中等查看答案及解析
-
下列各分子中,所有原子都满足最外层为8电子结构的是( )
A、PCl5 B、BF3 C、NCl3 D、H2O
难度: 简单查看答案及解析
-
对化学反应限度的叙述,错误的是( )
A、任何可逆反应都有一定的限度 B、化学反应达到限度时,正逆反应速率相等
C、化学反应的限度与时间的长短无关 D、化学反应的限度是不可改变的
难度: 中等查看答案及解析
-
a、b、c、d四个集气瓶中,分别盛有H2、Cl2、HCl、HBr中的任意一种,将a和b两瓶气体混合后见光发生爆炸,将b和d两瓶气体混合后,瓶壁上出现红棕色的小液滴,由此可判断,c瓶中盛放的气体是( )
A、HCl B、H2 C.、Cl2 D、HBr
难度: 中等查看答案及解析
-
下列分子或离子的电子式书写正确的是( )
难度: 中等查看答案及解析
-
下列物质中,既含有离子键,又含有非极性共价键的是( )
A、Na2O2 B、NaOH C、CaCl2 D、H2O2
难度: 中等查看答案及解析
-
A和B为短周期元素, A— 和 B2+ 具有相同的电子层结构, 下列比较中正确的是( )
A、原子半径 A > B B、离子半径 A— > B2+
C、A在B的下一周期 D、A可能是金属元素
难度: 困难查看答案及解析
-
下列叙述中正确的是( )
A、离子化合物中不一定含有金属元素
B、同周期元素的原子半径越小, 越容易失去电子
C、同周期非金属元素的原子半径越小, 气态氢化物的稳定性越弱
D、离子化合物都属于强电解质, 一定都易溶解于水
难度: 中等查看答案及解析
-
反应A(g)+3B(g)
2C(g)+2D(g),在不同情况下测得反应速率,反应速率最快的是( )
A、υ (C)=0.5 mol / (L·s) B、υ(D)=0.4 mol / (L·s)
C、υ(B)=0.6 mol / (L·s) D、υ(A)=0.15 mol / (L·s)
难度: 中等查看答案及解析
-
硒为第四周期VIA族元素,根据它在周期表中的位置推断,硒不可能具有的性质为:
A、在通常状况下是固体 B、SeO3的水化物为酸
C、H2Se比H2S稳定 D、硒元素有+4、+6、-2三种常见化合价
难度: 中等查看答案及解析
-
运用元素周期表的变化规律,下列判断不正确的是( )
A、铍是一种轻金属,它的氧化物对应的水化物可能是两性氢氧化物
B、硫酸锶(锶为IIA族)难溶于水和稀硝酸,其氢氧化物一定是强碱
C、砹是一种有色固体,它的气态氢化物很稳定
D、碱性强弱:KOH>NaOH>Mg(OH)2>Al(OH)3
难度: 中等查看答案及解析
-
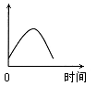 镁是生产铝合金必需的添加材料。镁合金被公认为“二十一世纪绿色环保新型材料”,可广泛运用于航空航天、汽车等10多个领域。目前全世界的镁金属年产量为60万吨,其中约80%由中国生产。现把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由右图表示。在下列因素中对产生H2速率没有影响的是( )
镁是生产铝合金必需的添加材料。镁合金被公认为“二十一世纪绿色环保新型材料”,可广泛运用于航空航天、汽车等10多个领域。目前全世界的镁金属年产量为60万吨,其中约80%由中国生产。现把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由右图表示。在下列因素中对产生H2速率没有影响的是( )A、溶液的温度 B、镁条的表面积 C、Cl—的浓度 D、H+的浓度
难度: 中等查看答案及解析
 ,B、C可形成离子化合物B3C2,据此填空:
,B、C可形成离子化合物B3C2,据此填空: