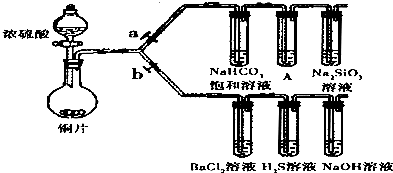
-
下列有关钠的叙述正确的是( )
①钠在空气中燃烧生成氧化钠 ②金属钠可以保存在煤油中
③钠与硫酸铜溶液反应,可以置换出铜 ④金属钠有强还原性
⑤钠原子的最外层上只有一个电子,所以在化合物中钠的化合价显+1价.
A.①②④
B.②③⑤
C.①④⑤
D.②④⑤难度: 中等查看答案及解析
-
某食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤;正确的操作顺序是( )
A.③②①⑤④
B.①②③⑤④
C.②③①⑤④
D.③⑤②①④难度: 中等查看答案及解析
-
下列物质的分类正确的一组是( )
A B C D 电解质 NH3 Na2CO3 NH4NO3 Fe(OH)3 非电解质 Cl2 HCl CO2 CH4 酸性氧化物 CO2 NO2 SiO2 CO 酸 HClO CH3COOH H2SiO3 HNO3
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
在酸性溶液中,能大量共存的离子组是( )
A.Mg2+、Fe3+、NO3-、SCN-
B.Al3+、Fe2+、Cl-、SO42-
C.K+、Na+、Cl-、HCO3-
D.Na+、Ba2+、NO3-、SO42-难度: 中等查看答案及解析
-
下列化学反应的离子方程式正确的是( )
A.将铝片加入烧碱溶液中:2Al+2OH-+2H2O=2AlO2-+3H2↑
B.将少量金属钠放人冷水中:Na+2H2O=Na++2OH-+H2↑
C.向亚硫酸钠溶液中加入足量硝酸:SO32-+2H+=SO2↑+H2O
D.向澄清石灰水中通入过量二氧化碳:CO2+Ca2++2OH-=CaCO3↓+H2O难度: 中等查看答案及解析
-
向含有0.078molFeCl2的溶液中通入0.009molCl2,再向其中加入含0.01molX2O72-的酸性溶液,使溶液中的Fe2+恰好完全被氧化,且X2O72-被还原为Xn+,则n值为( )
A.2
B.3
C.4
D.5难度: 中等查看答案及解析
-
下列对实验现象或结论的预测正确的是( )
A.向苯酚钠溶液中通入CO2,溶液变浑浊,继续通入CO2至过量,又变澄清
B.向银氨溶液中滴加盐酸至过量,开始有沉淀出现,后来沉淀又溶解
C.向NaAlO2溶液中通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失
D.向NaOH溶液中通入足量CO2,再加入少量Ba(OH)2溶液,CO32-浓度增大难度: 中等查看答案及解析
-
菲的结构简式可表示为
,若菲分子中有1个H原子被Cl原子取代,则所得一氯取代产物有( )
A.4种
B.5种
C.10种
D.14种难度: 中等查看答案及解析
-
如图中的两条线分别代表的是:1g C3H6和1g M气体在相同容积的容器中,测得容器中的压强和温度的关系,试根据图形判断M气体可能是( )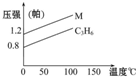
A.C3H8
B.C2H4
C.H2S
D.N2O4难度: 中等查看答案及解析
-
向含有0.2mol氢氧化钠和0.1mol氢氧化钙的溶液中,持续稳定地通入二氧化碳气体,通入气体为6.72L(标准状况)时,立即停止,则这一过程中,溶液中离子数目与通入二氧化碳气体体积的关系正确的是(不考虑气体的溶解)( )
A.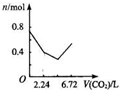
B.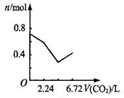
C.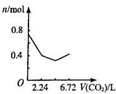
D.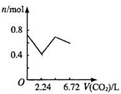
难度: 中等查看答案及解析
-
下列溶液能与镁反应生成氢气的是( )
A.氯化铵溶液
B.氢氧化钠溶液
C.碳酸钾溶液
D.饱和石灰水难度: 中等查看答案及解析
-
有BaCl2和NaCl的混合溶液a L,将它均分成两份.一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀.反应中消耗 x mol H2SO4、y mol AgNO3.据此得知原混合溶液中的c(Na+)为( )
A.mol/L
B.mol/L
C.mol/L
D.mol/L
难度: 中等查看答案及解析
-
小强在奥运五连环中填入了5种物质,使相连环物质间能发生反应,不相连环物质间不能发生反应.你认为“五连环”中物质间发生的反应,没有涉及的基本反应类型和属于氧化还原反应的个数为( )
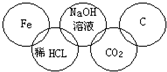
A.化合反应、3个
B.分解反应、2个
C.复分解反应、1个
D.置换反应、2个难度: 中等查看答案及解析
-
天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述正确的是( )
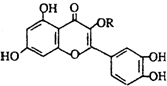
A.若R为甲基则该物质的分子式可以表示为C16H10O7
B.分子中有三个苯环
C.1mol该化合物与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4 mol、8 mol
D.1mol该化合物最多可与5molBr2完全反应难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.常温常压下,11.2 L氯气所含有的原子数为6.02×1023
B.常温常压下,28 g氮气所含有的原子数为6.02×1023
C.同温同压下,相同体积的任何气体单质所含的原子数目相同
D.在标准状况下,0.5×6.02×1023个氧气分子所占的体积为11.2 L难度: 中等查看答案及解析