-
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出FeSO47H2O。
Ⅱ.将FeSO47H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀, 干燥后得到FeCO3固体。
干燥后得到FeCO3固体。
Ⅴ.煅烧FeCO3,得到Fe2O3固体。
已知:NH4HCO3在热水中分解。
(1)Ⅰ中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是_________________。
(2)Ⅱ中,需加一定量硫酸。运用化学平衡原理简述硫酸的作用_____________。
(3)Ⅲ中,生成FeCO3的离子方程式是_____________。若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是_____________。
(4)Ⅳ中,通过检验SO42-来判断沉淀是否洗涤干净。检验SO42-的操作是_____________。
(5)已知煅烧FeCO3的化学方程式是4FeCO3+O2 2Fe2O3+4CO2。现煅烧464.0kg的FeCO3,得到316.8kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是_________kg。(摩尔质量/gmol-1:FeCO3116Fe2O3160FeO72)
2Fe2O3+4CO2。现煅烧464.0kg的FeCO3,得到316.8kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是_________kg。(摩尔质量/gmol-1:FeCO3116Fe2O3160FeO72)
-
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出FeSO4•7H2O.
Ⅱ.将FeSO4•7H2O配制成溶液.
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液.
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeCO3固体.
V.煅烧FeCO3,得到Fe2O3固体.
已知:NH4HC03在热水中分解.
(1)Ⅰ中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是______.
(2)Ⅱ中,需加一定量硫酸.运用化学平衡原理简述硫酸的作用______.
(3)Ⅲ中,生成FeCO3的离子方程式是______.若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是______.
(4)IV中,通过检验SO42-来判断沉淀是否洗涤干净.检验SO42的操作是______.
(5)已知煅烧FeCO3的化学方程式是4FeCO3+O2  2Fe2O3+4CO2.现煅烧464.0kg的FeCO3,得到316.8kg产品.若产品中杂质只有FeO,则该产品中Fe2O3的质量是______Kg.
2Fe2O3+4CO2.现煅烧464.0kg的FeCO3,得到316.8kg产品.若产品中杂质只有FeO,则该产品中Fe2O3的质量是______Kg.
-
工业以黄铜矿(主要成分是CuFeS2)为原料制备粗铜,进一步以粗铜为原料制备CuSO4·5H2O晶体。工艺流程如下(部分操作和条件略):
I. 煅烧黄铜矿,得到粗铜(含铁及铁、铜的化合物等);
II. 向粗铜中加入稀H2SO4和稀HNO3,并使产生的NO与H2O、O2反应;
III. 调节Ⅱ中所得溶液的pH,过滤;
Ⅳ. 将Ⅲ中滤液浓缩后冷却结晶,过滤,得到CuSO4·5H2O晶体。
已知:生成氢氧化物的pH
| Cu(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 4.8 | 1.5 |
| 完全沉淀时 | 6.7 | 2.8 |
注:金属离子的起始浓度为0.1 mol/L
请回答:
(1)I中主要发生如下两个化学反应。请将反应ii的化学方程式补充完整。
i. 2CuFeS2+4O2 Cu2S+3SO2+2FeO
Cu2S+3SO2+2FeO
ii.  Cu2S+
Cu2S+ O2
O2 
 _________+
_________+  SO2
SO2
(2)II中NO与H2O、O2反应的化学方程式是_________。
(3)III中的滤渣主要是Fe(OH)3。调节溶液的pH时,pH范围是_________。
(4)有关上述过程的说法中,正确的是_________(填序号)。
a. I中尾气含有SO2,可综合利用制备H2SO4。
b. II中稀HNO3的作用之一是使Cu单质转化为Cu2+
c. 在上述过程中,HNO3可循环利用
-
以硫铁矿(主要成分为FeS2)为原料制备硫酸亚铁晶体(FeSO4·7H2O)的工艺流程如下:
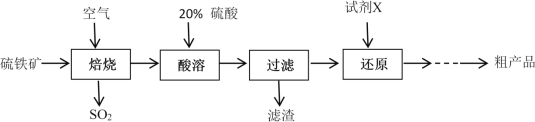
回答下列问题:
(1)焙烧后得到的固体主要成分为Fe2O3。写出焙烧过程主要反应的化学方程式____________________
(2)试剂X是(写化学式)__________________
(3)设计实验检验还原得到的溶液是否达标:_________________________________________
(4)从还原得到的溶液中获得硫酸亚铁晶体(FeSO4·7H2O)的操作是_______________________
(5)可以用标准浓度的酸性KMnO4溶液来测定产品中FeSO4的纯度,反应中KMnO4被还原成Mn2+。反应的离子方程式为 __________________________________
(6)某种工业品中含有FeSO4和Fe2(SO4)3。通过元素分析得知其中铁元素和硫元素的物质的量之比n(Fe)︰n(S) =1︰1.2 ,此工业品中FeSO4的物质的量分数为___________________________
-
以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:
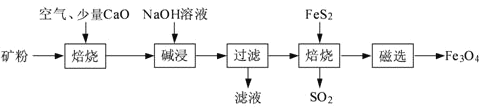
(1)粉碎高硫铝土矿石的目的是______。
(2)焙烧时发生氧化还原反应:______FeS2+______O2 ______Fe2O3+______SO2↑,配平该方程式。
______Fe2O3+______SO2↑,配平该方程式。
(3)碱浸时发生反应的化学方程式为______。
(4)过滤后向滤液中通入过量的CO2气体,反应的离子方程式为______。
(5)“过滤”得到的滤渣中含有大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2):n(Fe2O3)=______。
-
以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:
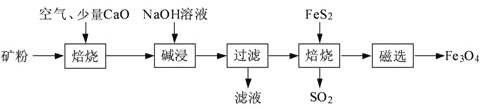
(1)粉碎高硫铝土矿石的目的是______。
(2)焙烧时发生氧化还原反应:______FeS2+______O2 ______Fe2O3+______SO2↑,配平该方程式。
______Fe2O3+______SO2↑,配平该方程式。
(3)碱浸时发生反应的化学方程式为______。
(4)过滤后向滤液中通入过量的CO2气体,反应的离子方程式为______。
(5)“过滤”得到的滤渣中含有大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2):n(Fe2O3)=______。
-
铝、铁、硅的单质及化合物在工业生产中具有广泛应用,工业上常用某矿石(主要成分有Al2O3、Fe2O3、FeO、SiO2等)来制备绿矾(FeSO4·7H2O)和氧化铝,其工艺流程如图:

回答下列问题:
(1)滤渣1的成分是___,举例说明滤渣2的用途___。
(2)用离子方程式表示溶液A加入过量铁粉的目的是___。
(3)写出由滤液1生成滤液2的离子方程式___。
(4)过程1、2、3均涉及分离操作,所需玻璃仪器有___。
(5)由溶液B得到绿矾的具体操作为___、过滤、洗涤和干燥。
(6)过程3需要加入的试剂A是___,写出此过程的离子方程式___。
-
利用钛白工业的副产品FeSO4(含Al2(SO4)3和少量重金属离子)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:
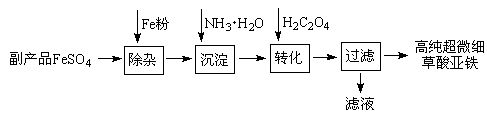
已知:①5Fe2++ MnO4-+8H+=5Fe3++Mn2++4H2O
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有 。
(2)滤液经处理可得到副产品 。
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入25 mL 2 mol·L-1的H2SO4溶解。
步骤2:用0.2000 mol·L-1标准KMnO4溶液滴定,消耗其体积30.40 mL。
步骤3:向滴定后的溶液中加入2 g Zn粉和5 mL 2 mol·L-1的H2SO4溶液,将Fe3+还原为Fe2+。
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.00 mL。
则样品中C2O42-的物质的量为 。(写出计算过程)
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应 液中Mn2+的浓度随反应时间t的变化如图,其变化趋势的原因可能为 。

-
焦亚硫酸钠(Na2S2O5)是葡萄酒中常用的抗氧化剂。一种以硫黄为原料制取Na2S2O5的生产工艺如下:

已知:结晶脱水发生的反应:
回答下列问题:
(1)Na2S2O5中硫元素的化合价为________。
(2)焚烧炉中反应的化学方程式为________________。
(3)反应器中发生反应的离子方程式为________________。
(4)葡萄酒酿造过程中添加Na2S2O5会放出一种有刺激性气味的气体,该气体是一种食品添加剂。实验室中检验该气体的常用试剂是________________。
(5)废水中的硫单质(S8)能与碱反应,化学反应: ,反应中氧化剂与还原剂的物质的量之比为________。
,反应中氧化剂与还原剂的物质的量之比为________。
-
富铁铝土矿(主要含有A12O3、Fe2O3、FeO和SiO2)可用于制备净水剂明矾KAl(SO4)2·12H2O和补血剂FeSO4·7H2O。工艺流程如下(部分操作和产物略去):
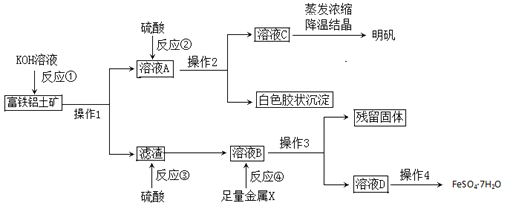
(1)操作1的名称是___________。
(2 )反应①②③④中是氧化还原反应的是_______(填写编号)。
)反应①②③④中是氧化还原反应的是_______(填写编号)。
(3)综合考虑,金属X最好选择的试剂是__,写出该反应离子方方程式_______。
(4)反应①的离子方程式是_________、__________。
(5)溶液D中含有的金属阳离子是_______,检验方法是________。
(6)用含铝元素27℅的上述矿石10吨,通过上述流程最多生产明矾____吨。






