-
工业以黄铜矿(主要成分是CuFeS2)为原料制备粗铜,进一步以粗铜为原料制备CuSO4·5H2O晶体。工艺流程如下(部分操作和条件略):
I. 煅烧黄铜矿,得到粗铜(含铁及铁、铜的化合物等);
II. 向粗铜中加入稀H2SO4和稀HNO3,并使产生的NO与H2O、O2反应;
III. 调节Ⅱ中所得溶液的pH,过滤;
Ⅳ. 将Ⅲ中滤液浓缩后冷却结晶,过滤,得到CuSO4·5H2O晶体。
已知:生成氢氧化物的pH
| Cu(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 4.8 | 1.5 |
| 完全沉淀时 | 6.7 | 2.8 |
注:金属离子的起始浓度为0.1 mol/L
请回答:
(1)I中主要发生如下两个化学反应。请将反应ii的化学方程式补充完整。
i. 2CuFeS2+4O2 Cu2S+3SO2+2FeO
Cu2S+3SO2+2FeO
ii.  Cu2S+
Cu2S+ O2
O2 
 _________+
_________+  SO2
SO2
(2)II中NO与H2O、O2反应的化学方程式是_________。
(3)III中的滤渣主要是Fe(OH)3。调节溶液的pH时,pH范围是_________。
(4)有关上述过程的说法中,正确的是_________(填序号)。
a. I中尾气含有SO2,可综合利用制备H2SO4。
b. II中稀HNO3的作用之一是使Cu单质转化为Cu2+
c. 在上述过程中,HNO3可循环利用
-
孔雀石的主要成分为Cu2(OH)2CO3,还含少量FeO、Fe2O3、SiO2。以下是实验室以孔雀石为原料制备CuSO4·5H2O晶体的流程图:
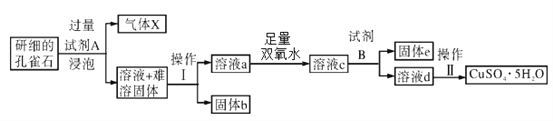
(1)试剂A的化学式为_____________;固体b的化学式为______________。
(2)生成气体X的化学方程式为_________________________________。
(3)已知:有关金属离子从开始沉淀到沉淀完全时溶液的pH如表所示
| Fe3+ | Cu2+ | Fe2+ |
| 开始沉淀的pH | 2.7 | 5.1 | 8.1 |
| 沉淀完全的pH | 3.0 | 6.7 | 9.6 |
加入足量双氧水的目的是___________________________________(用离子方程式表示)。设计实验方案证明加入的双氧水已足量_____________________________________(实验方案包括试剂、现象和结论)。
(4)① 试剂B的使用是为了调节溶液的pH,使Fe3+转化为沉淀予以分离。试剂B可选用__________________。
A.NaOH溶液 B. Cu C.CuO D.Cu2(OH)2CO3
② 为完全除去溶液c中的Fe3+而又不使Cu2+沉淀,则应调节溶液pH的范围为________________。
(5)操作Ⅱ包括__________________、洗涤、干燥。
-
废弃物的综合利用既有利于节约资源,又有利于保护环境,实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4·5H2O)及副产物ZnO,制备流程图如下:
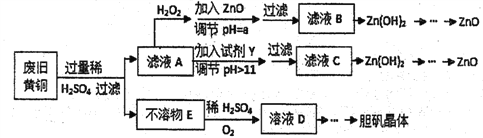
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH熔液生成[Zn(OH)4]2-下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0 mol/L计算)。
| Fe 3+ | Fe2+ | Zn2+ |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 沉淀完全的pH | 3.0 | 8.8 | 8.9 |
请回答下列问题:
(1)滤液A中加入H2O2反应的离子方程式为__________________________________。
(2)加入ZnO调节pH=a的目的是___________________,a的范围是______________。
(3)下列试剂可作为Y试剂的是______________。
A.ZnO B.NaOH C.Na2CO3 D.ZnSO4
(4)若在滤液C中逐滴加入盐酸直到过量,则产生的现象是____________________。
(5)由不溶物E生成溶液D的化学方程式为____________________________________。
(6)由溶液D制胆矾晶体包含的主要操作步骤是,蒸发浓缩、________、____________。
-
(1)利用反应 可制备CuSO4溶液,且反应简便无污染,若将该反应设计为原电池,其正极电极反应式为_____________________。
可制备CuSO4溶液,且反应简便无污染,若将该反应设计为原电池,其正极电极反应式为_____________________。
(2)工业上由黄铜矿(主要成分CuFeS2)冶炼铜的过程中会产生二氧化硫气体和固体熔渣混合物,用稀H2SO4浸泡熔渣,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在Fe3+,检验溶液中是否存在Fe2+的最好的方法是_________________________(用化学反应方程式或离子方程式说明)。
(3)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是_______________。
a.电能全部转化为化学能 b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动 d.利用阳极泥可回收Ag、Pt、Au等金属
(4)用惰性电极电解CuSO4溶液,若只有阳极产生气体,则所得溶液的pH_______(填变大、变小、不变,不考虑溶液体积变化),要使电解质溶液恢复到电解前的状态,可加入____________;若阴阳两极均有气体生成,要使电解质恢复到电解前的状态,可加入__________,当加入该物质1mol即恢复到电解前状态,则电解时电路中转移电子的物质的量为__________摩尔。
-
(16分)以锌铜合金的废料为原料制备硫酸铜晶体(CuSO4·5H2O)的部分工艺流程如图所示:

(1)酸溶时,铜转化为Cu2+的离子方程式为 ,锌铜合金要剪成碎片且反应过程要不断搅拌,其目的是 。
(2)为使酸溶后的溶液中不含NO3-,配制混酸稀溶液时,应控制硫酸与硝酸的物质的量之比不小于 。
(3)“系列操作”为 、 、过滤、洗涤、干燥。
(4)测定除锌后的溶液中Cu2+离子浓度的方法为:准确量取V1mL除锌后的溶液于锥形瓶中,调节pH=3~4,加入过量KI,充分反应后,滴加2滴淀粉溶液,再慢慢滴加c mol/L Na2S2O3标准溶液至恰好完全反应,消耗Na2S2O3标准溶液V2 mL。已知: 2Cu2++4I-=2CuI↓+I2 2S2O32-+I2=S4O62-+2I-
①“恰好反应”时溶液的颜色变化为 。
②Cu2+离子的物质的量浓度为 mol/L(用V1 、V2、c表示)。
③若除锌后的溶液中仍含有NO3-离子,则测定结果会 (填“偏大”、“偏小”、“无影响”)。
-
以黄铜矿(CuFeS2)、FeCl3和乳酸[CH3CH(OH)COOH]为原料可制备有机合成催化剂CuCl和补铁剂乳酸亚铁{[CH3CH(OH)COO]2Fe}。其主要实验流程如下:
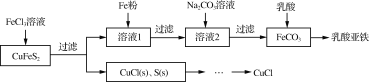
(1)FeCl3溶液与黄铜矿发生反应的离子方程式为_________。
(2)向溶液1中加入过量铁粉的目的是_____________。
(3)过滤后得到的FeCO3固体应进行洗涤,检验洗涤已完全的方法是___________。
(4)实验室制备乳酸亚铁的装置如图1所示。
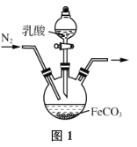
①实验前通入N2的目的是________。
②某兴趣小组用KMnO4滴定法测定样品中Fe2+含量进而计算产品中乳酸亚铁的质量分数,结果测得产品的质量分数总是大于100%,其原因可能是______________。
(5)已知:①CuCl为白色晶体,难溶于水和乙醇,在空气中易氧化;可与NaCl溶液反应,生成易溶于水的NaCuCl2。
②NaCuCl2可水解生成CuCl,温度、pH对CuCl产率的影响如图2、3所示。
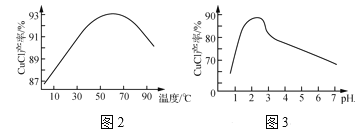
由CuCl(s)、S(s)混合物提纯CuCl的实验方案为:将一定量的混合物溶于饱和NaCl溶液中,______。
(实验中须使用的试剂有:饱和NaCl溶液,0.1 mol·L-1 H2SO4、乙醇;除常用仪器外须使用的仪器有:真空干燥箱)。
-
绿矾被广泛用于医药和工业领域,工业上两种制备绿矾(FeSO4·7H20)的流程如图所示,根据题意回答下列问题:
方法一:利用黄铜矿粉(主要成分为CuFeS2)制取绿矾
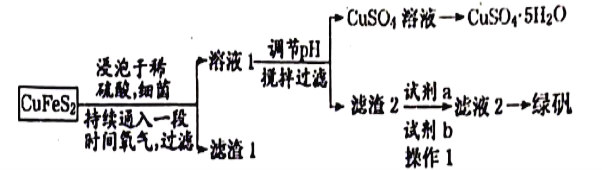
(1)试剂a和试剂b的化学式分别是__________________________, 操作1的名称是_____________。
(2)有一种细菌在有氧气存在的稀硫酸中,可以将CuFeS2氧化成硫酸盐,写出该反应的化学方程式:____________________________________________________。
方法二:利用工业废铁屑制取绿矾
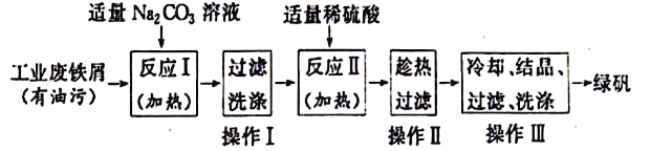
(3)操作Ⅰ需要用到的玻璃仪器名称是__________________________。
(4)通过检验CO32-来判断操作Ⅰ是否洗涤干净,检验的方法是__________________________。
-
工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:

(1)气体A中的大气污染物可选用下列试剂中的 吸收.
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在 (填离子符号),检验溶液中还存在Fe2+的方法是
(3)由泡铜冶炼粗铜的化学反应方程式为 .
(4)取一定量的泡铜,加入1L0.6mol/LHNO3溶液恰好完全溶解,同时放出2240mLNO气体(标准状况),另取等量的泡铜,用足量的H2还原,得到的铜的质量为 g.
-
黄铜矿(主要成分为CuFeS2)是海洋矿物中的一种,它是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。请回答下列问题:
(1) 利用黄铜矿冶炼铜的反应为8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2。已知CuFeS2中Fe的化合价为+2,Cu的化合价为+2,
8Cu+4FeO+2Fe2O3+16SO2。已知CuFeS2中Fe的化合价为+2,Cu的化合价为+2,
① 反应中被还原的元素是________(填元素符号),
② 生成1 mol Fe2O3时转移电子的物质的量为________mol。
(2)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,方法为:①用过量稀盐酸浸取炉渣,过滤。②先将滤液氧化,再向其中加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。据以上信息回答下列问题:
A.①中过滤的目的是____________________,
B.②中将滤液氧化常常选用H2O2,其反应的离子方程式为____________________。
C.只能选用提供的试剂,设计实验验证炉渣中含有FeO。提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水,
① 所选试剂为___________________
② 证明炉渣中含有FeO的实验现象为_____________________
-
“铜都”安徽铜陵有许多黄铜矿(主要成分为CuFeS2,含少量Al2O3、SiO2),黄铜矿是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。
(1)火法炼铜首先要焙烧黄铜矿,其反应原理为2CuFeS2+O2 Cu2S+2FeS+SO2。CuFeS2中Cu和Fe元素的化合价均为+2价,若反应中转移0.3mol电子时,则标准状况下,产生SO2的体积为________L。
Cu2S+2FeS+SO2。CuFeS2中Cu和Fe元素的化合价均为+2价,若反应中转移0.3mol电子时,则标准状况下,产生SO2的体积为________L。
(2)焙烧黄铜矿产生的Cu2S可被稀硝酸氧化为Cu2+ 和硫单质,HNO3的还原产物为NO,试写出Cu2S与稀硝酸反应的离子方程式,并用双桥式表示电子转移__________________。
(3)焙烧黄铜矿还可得到Cu2O,将21.6g Cu2O加入到500mL某浓度的稀硝酸中,固体物质完全反应,生成Cu(NO3)2和NO,在所得溶液中加入1.0mol∙L-1的NaOH溶液1.0L,此时溶液呈中性。原硝酸的物质的量浓度为___________。
Cu2S+3SO2+2FeO
Cu2S+
O2
_________+
SO2


 可制备CuSO4溶液,且反应简便无污染,若将该反应设计为原电池,其正极电极反应式为_____________________。
可制备CuSO4溶液,且反应简便无污染,若将该反应设计为原电池,其正极电极反应式为_____________________。





