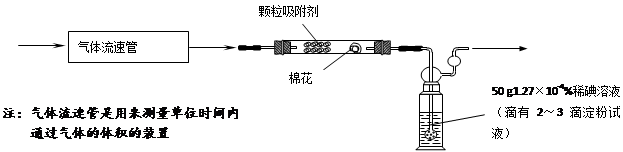
-
家庭常用的生粉和去污粉都是白色粉状固体,外观极为相似。生粉主要成分是淀粉,去污粉主要成分是碳酸钠和极细的沙子。下列可以用来区别它们的物品是
A.食用油 B.酱油 C.白醋 D.碘酒
难度: 中等查看答案及解析
-
某同学利用一黑色粉末(含氧化铜、碳粉、铁粉中的一种或多种)和未知溶质质量分数的稀硫酸,做如下探究:将a g黑色粉末加入到盛有50 g该稀硫酸的烧杯中,充分反应后称得烧杯内物质质量为(49.8+a)g。他对实验的推理正确的是
A.反应后不可能得到红色固体
B.黑色粉末中含有铁粉,加入黑色粉末质量一定为5.6 g
C.若反应后黑色粉末无剩余,则黑色粉末中一定不含有碳粉
D.该稀硫酸中溶质的质量分数不低于19.6%
难度: 中等查看答案及解析
-
下列实验方法不能够达到目的的是
A.用湿润的红色石蕊试纸区别氨气和氯化氢气体
B.用锌粒和浓盐酸两种试剂制取干燥纯净的氢气
C.用高锰酸钾溶液检测二氧化碳气体中是否含有二氧化硫气体
D.向鸡蛋清溶液中加入少量浓硝酸并微热以检验蛋白质的存在
难度: 中等查看答案及解析
-
2007年3月26日,央视《生活315》披露了“胡师傅无烟不粘健康紫砂锅”的真相,引起了全国亿万观众的关注。据检测这种锅所使用的材料是铝合金而不是锰钛合金,所谓的紫砂只是一种紫砂颜色的涂料。其实紫砂主要成分是氧化硅和氧化铁,紫砂是:
A、金属材料 B、无机非金属材料 C、有机合成材料 D、复合材料
难度: 中等查看答案及解析
-
复合材料集中了合成材料的优点,具有综合性能更优异的特点。下列材料中不属于复合材料的是
A.机动车轮胎 B.玻璃钢 C.有机玻璃 D.钢筋混凝土
难度: 中等查看答案及解析
-
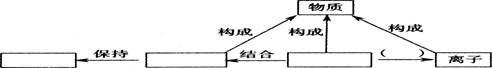
按照一定的依据把物质进行分类,是我们认识物质的组成、结构、性质和用途的便捷途径。张颖同学在家中建立了小小化学实验室,他收集了许多物质,其中有:①纯碱;②生石灰;③醋酸(CH3COOH);④熟石灰;⑤酒精(C2H6O);⑥铜;⑦石墨;⑧氧化铁;⑨蔗糖(C12H22O11);⑩尿素《CO(NH2)2》。对上述物质的分类不正确的是:
A.属于有机物的有③⑤⑨⑩ B.属于单质的有⑥⑦
C.属于碱的有①④ D.属于氧化物的有②⑧
难度: 中等查看答案及解析
-
某化学活动小组提出了以下四条设想,你认为将来合理而且可行的是
A.在工业上采用过滤的方法淡化海水来解决我国的淡水危机
B.让塑料制品完全“走出”我们的生活,来解决“白色污染”
C.用高梁、薯类等制取酒精代替汽油作为内燃机的燃料
D.利用太阳能分解水的方法获得大量氢能源
难度: 中等查看答案及解析
-
在甲、乙两支完全相同的试管中,装有足量质量相等且同样的稀盐酸,在两只试管上方各罩一个完全相同的气球,两个气球中分别装有质量相同的金属A和B。现同时提起两只气球,使其中的金属迅速与稀盐酸接触反应。实验发现:开始时,甲气球迅速鼓起,而乙气球鼓起较慢;反应结束时,甲气球鼓起比的体积比乙气球的大。根据以上事实,下列推论错误的是:
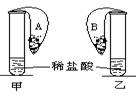
A.金属A比金属B活泼 B.A可能是锌 B可能是铁
C.A可能是Mg B可能是铝 D.A可能是Mg B可能是铁
难度: 中等查看答案及解析
-
已知升温、提高浓度、加大压强和使用催化剂均可以提高化学反应的速率。潘瑞同学发现把除去氧化膜的镁条投入盛有稀盐酸的试管中,试管外壁用手一摸感到发烫,而且产生氢气的速率变化情况和反应进行的时间的关系如右图所示, 则下列关于速率变化的主要原因说法正确的是:
A.t1~t2速度变化的主要原因是反应放热使溶液温度升高
B.t1~t2速度变化的主要原因是反应物的量较多
C.t2~t3速度变化的主要原因是盐酸的浓度逐渐减小
D.t2时恰好完全反应
难度: 中等查看答案及解析