-
化学与生产生活、环境保护密切相关。下列说法中不正确的是
A.食盐既可作调味品也可作食品防腐剂
B.向海水中加入净水剂明矾可以使海水淡化
C.加大石油、煤炭的开采速度,增加化石燃料的供应不利于“蓝天工程”的建设
D.高铁车厢材料大部分采用铝合金,因为铝合金强度大、质量轻、抗腐蚀能力强
难度: 简单查看答案及解析
-
下列化学用语的表示正确的是
A.CS2的比例模型:
B.乙醇的结构简式:C2H6O
C.核内有8个中子的碳原子: 86C
D.HClO的结构简式:H—Cl—O
难度: 简单查看答案及解析
-
下列有关物质的性质和应用都正确的是
A.氢氟酸具有强酸性,可用于雕刻玻璃
B.氨气显碱性,可用碱石灰或无水CaCl2干燥
C.MgO、A12O3熔点高,它们都可用于制作耐火材料
D.铜的活动性比铁弱,可在海轮外壳装铜块减缓海轮腐蚀
难度: 中等查看答案及解析
-
下列实验操作不能达到预期目的的是
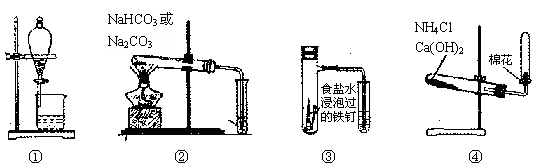
A.①分离CH3COOC2H5和饱和碳酸钠溶液
B.②鉴别碳酸钠和碳酸氢钠
C.③铁的吸氧腐蚀实验
D.④实验室制备氨气
难度: 中等查看答案及解析
-
下列物质中,能使酸性高锰酸钾溶液褪色的是
A.苯 B.乙烷 C.乙烯 D.乙酸
难度: 简单查看答案及解析
-
下列关于有机物的描述正确的是
A.葡萄糖和果糖互为同分异构体,淀粉和纤维素也互为同分异构体
B.淀粉、油脂和蛋白质都能发生水解反应
C.多糖、蛋白质、脂肪和聚丙烯都属于高分子化合物
D.汽油、柴油和植物油都是碳氢化合物
难度: 简单查看答案及解析
-
有机物
的一氯代物种类有(不考虑立体异构)
A.5种 B.6种 C.7种 D.8种
难度: 中等查看答案及解析
-
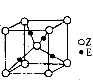
短周期主族元素X、Y、W、Z的原子序数依次增大。其中X、Z同主族,Z的单质是一种良好的半导体材料,W3+与Y2—具有相同的核外电子数。下列叙述正确的是
A.Y2—的离子半径大于W3+的离子半径
B.Y、Z形成的化合物为离子化合物
C.Z的最高价氧化物对应的水化物的酸性比X的强
D.X的气态简单氢化物的稳定性比Y的强
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A.钠和硫酸铜溶液反应:2Na+Cu2+=2Na++Cu
B.AlCl3溶液中加入足量的氨水制Al(OH)3:Al3++3OH—=Al(OH)3↓
C.向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO3—+OH—=CaCO3↓+H2O
D.二氧化硅溶于NaOH溶液:SiO2+2OH—=SiO32—+H2O
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.200 mL1 mol Al2(SO4)3溶液中,Al3+和SO42—离子数的总和为NA
B.标准状况下,2.24 L乙醇中含有的C—H键数目为0.5NA
C.0.1 mol Na完全被氧化生成Na2O2,转移电子的数目为0.1NA
D.0.1 mol O2和O3的混合气体中含氧原子数目为0.2NA
难度: 中等查看答案及解析
-
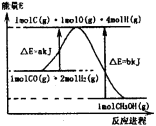
已知如下两个热化学反应
(l)+H2(g)→
(l)
H>0 ①
(l)+2H2(g)→
(l)
H<0 ②
下列说法不正确的是
A.反应①、②都属于加成反应
B.l,3一环己二烯比苯稳定
C.反应①、②的热效应说明苯环中含有的并不是碳碳双键
D.反应①、②中的所有有机物均可使溴水褪色,但褪色原理不完全相同
难度: 中等查看答案及解析
-
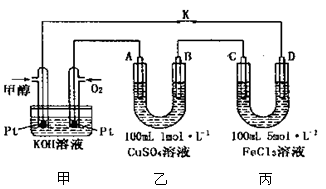
镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。如图为“镁一次氯酸盐”燃料电池示意图,电极为镁合金和铂合金。关于该电池的叙述正确的是
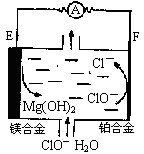
A.E为该燃料电池的正极
B.负极发生的电极反应式为ClO—+2e—+H2O=Cl—+2OH—
C.电池工作时,正极周围溶液的pH将不断变小
D.镁燃料电池负极能发生自腐蚀产生氢气,使负极利用率降低
难度: 中等查看答案及解析
-
已知平衡:①C2H4(g)
C2H2(g)+H2(g),②2CH4(g)
C2H4(g)+2H2(g)。当升高温度时,①和②式皆向右移动。
(1)C(s)+2H2(g)
CH4(g)
H1
(2)2C(s)+H2(g)
C2H2(g)
H2
(3)2C(s)+2H2(g)
C2H4(g)
H3
下列有关(1)、(2)和(3)中的
H1、
H2、
H3大小顺序排列正确的是
A.
H1>
H2>
H3 B.
H2>
H3>2
H1
C.
H2>
H1>
H3 D.
H3>
H2>2
H1
难度: 中等查看答案及解析
-
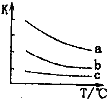
CH4和N2在一定条件下能直接生成氨:3CH4(g)+2N2(g)
3C(s)+4NH3(g)
H>0,700 ℃时,
与CH4的平衡转化率的关系如图所示。下列判断正确的是
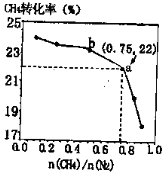
A.
越大,CH4的转化率越高
B.
不变时,升温,NH3的体积分数会减小
C.b点对应的平衡常数比a点的大
D.a点对应的NH3的体积分数约为13%
难度: 困难查看答案及解析