-
短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁原子最外层电子数与电子层数相等,则( )
A. 原子半径:丙>丁>乙
B. 单质的还原性:丁>丙>甲
C. 甲、乙、丙的氧化物均为共价化合物
D. 乙、丙、丁的最高价氧化物对应的水化物能相互反应
难度: 困难查看答案及解析
-
下列酸与金属发生反应时,硫元素或氮元素的化合价不发生变化的是( )
A.浓硫酸 B.稀硝酸 C.浓硝酸 D.稀硫酸
难度: 中等查看答案及解析
-
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
A. 质子数:c>d B. 离子的还原性:Y2->Z-
C. 氢化物的稳定性:H2Y>HZ D. 原子半径:X<W
难度: 中等查看答案及解析
-
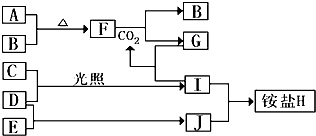
一种盐X与氢氧化钠共热,可放出无色气体Y,Y经过一系列氧化后再溶于水可得Z溶液,Y和Z溶液反应又生成X,则X可能是下列中的( )
A.(NH4)2SO4 B.NH4NO3 C.NH4Cl D.NH4HCO3
难度: 中等查看答案及解析
-
在一定条件下,RO3-与R-可发生反应:RO3-+5R-+6H+===3R2+3H2O,下列关于R元素的叙述中,正确的是( )
A. 元素R位于周期表中第ⅤA族
B. RO3-中的R只能被还原
C. R2在常温常压下一定是气体
D. 若1 mol RO3-参与该反应,则转移的电子的物质的量为5 mol
难度: 中等查看答案及解析
-
下列各项表述正确的是( )
A. 1H、2H、3H互为同素异形体 B. 二氧化碳的结构式为O-C-O
C. S2-的结构示意图:
 D. NH4Cl的电子式:
D. NH4Cl的电子式: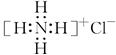
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 铵盐都能与碱反应,不与酸反应
B. 液氨汽化吸热,可用液氨作制冷剂
C. 浓硫酸具有吸水性,能使蔗糖炭化
D. 常温下,铁、铝不与浓硫酸反应,因此可以用铁、铝容器贮存运输浓硫酸
难度: 中等查看答案及解析
-
下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
A. K+、Ba2+、OH-、SO42- B. Cu2+、NH4+、Br-、OH-
C. H+、NO3-、Fe2+、Na+ D. Ag+、Cl-、Fe2+、K+
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 1molCl2与足量Fe反应,转移的电子数为3NA
B. 在常温常压下,1.7g NH3中含有共价键的数目为0.3NA
C. 标准状况下,11.2 LSO3中含有的原子数是2NA
D. 0.2 mol∙L-1的 Na2SO4溶液中含Na+数目为0.4NA
难度: 中等查看答案及解析
-
能把K2SO4,(NH4)2SO4 ,NH4Cl,NaNO3四种溶液区别开来(可加热)的一种试剂是( )
A. BaCl2 B. NaOH C. Ba(NO3)2 D. Ba(OH)2
难度: 中等查看答案及解析
-
在实验探究课上,同学们积极思考,涉及以下实验方案用以验证浓硫酸的吸水性,其中在理论上可行的方案有几种( )
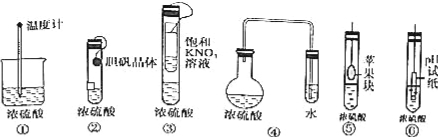
A.3种 B.4种
C.5种 D.6种
难度: 中等查看答案及解析
-
下列关于指定粒子构成的几种描述中不正确的是( )
A. 37Cl与39K具有相同的中子数
B. H3O+与OH-具有相同的质子数和电子数
C. O22-和S2-具有相同的质子数和电子数
D. 第114号元素的一种核素
X与82Pb具有相同的最外层电子数
难度: 中等查看答案及解析
-
同一周期的X、Y、Z三种元素,已知它们最高价氧化物对应水化物的酸性强弱是H3XO4<H2YO4<HZO4,下列推断不正确的是( )
A. 原子序数:X<Y<Z B. 气态氢化物稳定性:XH3<H2Y<HZ
C. 元素的非金属性强弱:X>Y>Z D. 最外层电子数:Z>Y>X
难度: 中等查看答案及解析
-
下列结论错误的是( )
①微粒半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥沸点:H2Se> H2S> H2O
⑦非金属性:O>N>P>Si
⑧金属性:Be<Mg<Ca<K
A. 只有① B. ①③⑥ C. ②④⑤⑥⑦ D. ①③⑤⑥
难度: 困难查看答案及解析
-
下列说法不正确的是( )
A. HF的热稳定性很好,是因为HF分子间存在氢键
B. 构成单质分子的粒子之间不一定存在共价键
C. 由非金属元素组成的化合物不一定是共价化合物
D. 阴、阳离子间通过离子键一定能形成离子化合物
难度: 中等查看答案及解析
-
下列变化需克服相同类型作用力的是( )。
A. 碘和干冰的升华 B. Na2O2和C60的熔化
C. 氯化氢和氯化钾的溶解 D. 溴的气化和NH4Cl加热分解
难度: 中等查看答案及解析
-
下列实验装置不能达到实验目的是( )
A. 用SO2做喷泉实验
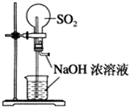
B. 验证Cu与浓硝酸反应的热量变化
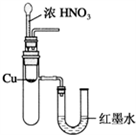
C. 验证NH3易溶于水
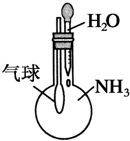
D. 比较Na2CO3与NaHCO3的稳定性
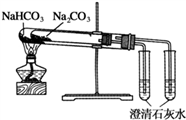
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A. 用KIO3 氧化酸性溶液中的KI: 5I-+IO3-+3H2O =3I2+6OH-
B.向NH4HCO3溶液中加过量的NaOH溶液并加热: NH4+ +OH-
NH3↑+H2O
C. 将过量SO2通入冷氨水中: SO2+NH3·H2O =HSO3-+NH4+
D. 用稀硝酸洗涤试管内壁的银镜: Ag+2H++NO3-=Ag++NO↑+H2O
难度: 中等查看答案及解析
-
已知阴离子R2-的原子核内有n个中子,R原子的质量数为m,则w g R2-所含有电子的物质的量是
A. mol B. mol C. (m-n-2)mol D. (m-n+2)mol
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )
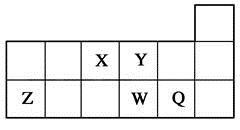
A. 元素X与元素Z的最高正化合价之和的数值等于8
B. 原子半径的大小顺序为:rX>rY>rZ>rW>rQ
C. 离子Y2-和Z3+的核外电子数和电子层数都不相同
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强
难度: 中等查看答案及解析
-
Q、R、T、M、W五种短周期元素在周期表中的相对位置如图所示,其中M的原子序数是R的原子序数的2倍。下列说法正确的是( )
A. MW6中各原子核外均满足8电子稳定结构
B. Q、W的单核离子的核外电子数相等
C. 五种元素均能形成氢化物
D. W的氢化物水溶液酸性最强,说明W的非金属性在五种元素中最强
难度: 中等查看答案及解析
-
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是
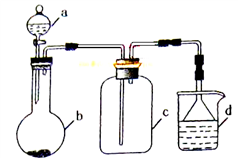
选项
a中的物质
b中的物质
c中收集的气体
d中的物质
A
浓氨水
CaO
NH3
H2O
B
浓硫酸
Na2SO3
SO2
NaOH溶液
C
稀硝酸
Cu
NO2
H2O
D
浓盐酸
MnO2
Cl2
NaOH溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某100mL混合液中,HNO3和H2SO4的物质的量浓度分别为0.4mol/L和0.1mol/L。向该混合液中加入1.92g铜粉,加热使反应发生完全。下列说法正确的是(忽略反应前后溶液体积变化)( )
A.所得溶液中c(Cu2+)=0.225mol/L B.所得溶液中c(Cu2+)=0.03mol/L
C.所得气体在标准状况下的体积为0.448L D.反应中转移0.06mol的电子
难度: 中等查看答案及解析