-
已知反应:2NO2(红棕色)
N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
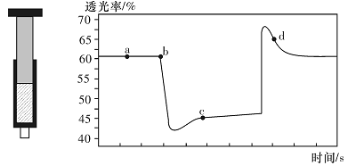
A.b点的操作是压缩注射器
B.c点与a点相比,c(NO2)增大,c(N2O4)减小
C.d 点:v(正)>v(逆)
D.若不忽略体系温度变化,且没有能量损失,则T(b)>T(c)
难度: 中等查看答案及解析
-
已知NO2与N2O4 可相互转化: 2NO2( g)
N2O4(g) △H=−24.2 kJ• mol−1,在恒温下, 将一定量和N2O4的混合气体充入体积为2 L的密闭容器中,其中物质的浓度随时间变化的关系如图所示。下列推理分析不合理的是
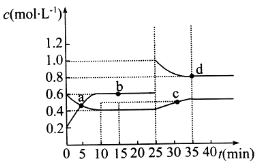
A.前10 min内,用v(NO2)表示的反应速率为0. 02 mol•L−1•min−1
B.反应进行到10 min时,体系吸收的热量为9.68 kJ
C.b、d两点中v(正)与v(逆)均相等
D.25 min时,正反应速率增大
难度: 中等查看答案及解析
-
CO2经催化加氢可合成乙烯:2CO2(g)+6H2(g)
C2H4(g)+4H2O(g)。0.1 MPa时,按n(CO2)∶n(H2)=l∶3投料,测得不同温度下平衡时体系中各物质浓度的关系如图。下列叙述不正确的是
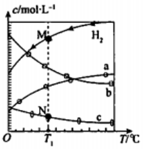
A.该反应的△H<0
B.曲线b代表H2O
C.N点和M点所处状态的c(H2)不一样
D.其他条件不变,T1℃、0.2 MPa下反应达平衡时c(H2)比M点大
难度: 中等查看答案及解析
-
在一定温度下,向容积为2 L的密闭容器中充入一定量的CO和NO2发生反应:4CO(g)+2NO2(g)
N2(g)+4CO2(g) ΔH<0。有关该反应的描述正确的是
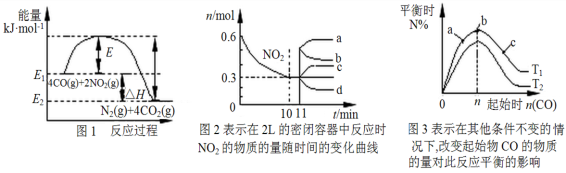
A.在一定温度、固定容积的密闭容器里,混合气体的密度不再改变可以说明上述可逆反应已达平衡
B.由图1可得加入适当的催化剂,E和ΔH 都减小
C.图2中0~10 min内该反应的平均速率v(CO)=0.03 mol·L−1·min−1,从11 min起其它条件不变,压缩容器的体积为1 L,则n(NO2)的变化曲线为d
D.图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2
难度: 中等查看答案及解析
-
臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g)
N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0 mol NO2和1.0 mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s
0
3
6
12
24
n(O2)/mol
0
0.36
0.60
0.80
0.80
下列有关说法正确的是
A.反应在0~3 s内的平均速率v(NO2)=0.24 mol·L−1·s−1
B.24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44 mol·L−1,则反应的ΔH>0
C.在T温度下,起始时向容器中充入2.0 mol N2O5和2.0 mol O2,达到平衡时,N2O5的转化率大于20%
D.在T温度下,起始时向容器中充入1.0 mol NO2、0.5 mol O3和0.50 mol N2O5、0.50 mol O2,反应达到平衡时,压强为起始时的0.88倍
难度: 中等查看答案及解析
-
合成氨的热化学方程式为 N2(g)+3H2(g)
2NH3(g) △H=−92.4 kJ/mol。现将l mol N2(g)、3 mol H2(g)充入一容积为2 L的密闭容器中,在500℃下进行反应,10 min 时达到平衡,NH3的体积分数为
,下列说法中正确的是
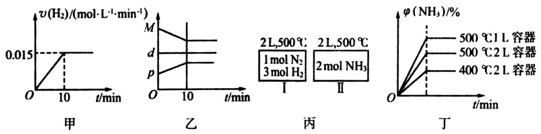
A.若达到平衡时,测得体系放出9.24 kJ热量,则H2反应速率变化曲线如图甲所示
B.反应过程中,混合气体平均相对分子质最为M,混合气体密度为d,混合气体压强为p,三者关系如图乙
C.如图丙所示,容器I和II达到平衡时,NH3的体积分数为
,则容器I放出热量与容器II吸收热量之和为92.4 kJ
D.若起始加入物料为1 mol N2,3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图丁所示
难度: 中等查看答案及解析
-
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)
2C(g),各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和如图表示:
容器
甲
乙
丙
容积
0.5L
0.5L
1.0L
温度/℃
T1
T2
T2
反应物
起始量
1.5molA
0.5molB
1.5molA
0.5molB
6.0molA
2.0molB
下列说法正确的是
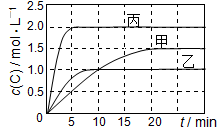
A.10 min内甲容器中反应的平均速率v(A)=0.025 mol/(L•min)
B.由图可知:T1<T2,且该反应为吸热反应
C.x=1,若平衡时保持温度不变,改变容器体积平衡移动
D.T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为75%
难度: 中等查看答案及解析
-
在3个2 L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:3H2(g)+N2(g)
2NH3(g)。按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下∶
容器
甲
乙
丙
反应物的投入量
3 molH2、2 molN2
6 molH2、4 molN2
2 molNH3
达到平衡的时间/min
5
8
平衡时N2的浓度/ mol·L-1
c1
1.5
NH3的体积分数
φ1
φ2
混合气体的密度/g·L-1
ρ1
ρ2
下列说法不正确的是
A.容器乙中反应从开始到达平衡的反应速率为v(H2)=0.3mol·L-1·min-1
B.在该温度下甲容器中反应的平衡常数K=
C.2c1<1.5
D.2ρ1=ρ2
难度: 中等查看答案及解析