-
合成氨的热化学方程式为 N2(g)+3H2(g) 2NH3(g) △H=−92.4 kJ/mol。现将l mol N2(g)、3 mol H2(g)充入一容积为2 L的密闭容器中,在500℃下进行反应,10 min 时达到平衡,NH3的体积分数为
2NH3(g) △H=−92.4 kJ/mol。现将l mol N2(g)、3 mol H2(g)充入一容积为2 L的密闭容器中,在500℃下进行反应,10 min 时达到平衡,NH3的体积分数为 ,下列说法中正确的是
,下列说法中正确的是
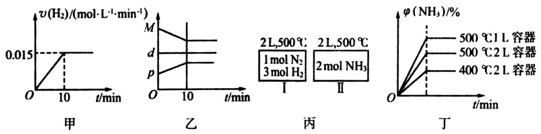
A.若达到平衡时,测得体系放出9.24 kJ热量,则H2反应速率变化曲线如图甲所示
B.反应过程中,混合气体平均相对分子质最为M,混合气体密度为d,混合气体压强为p,三者关系如图乙
C.如图丙所示,容器I和II达到平衡时,NH3的体积分数为 ,则容器I放出热量与容器II吸收热量之和为92.4 kJ
,则容器I放出热量与容器II吸收热量之和为92.4 kJ
D.若起始加入物料为1 mol N2,3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图丁所示
-
合成氨反应的热化学方程式为:N2(g)+3H2(g)
 2NH3(g);△H=-92.4kJ/mol现将1molN2和3molH2加入到2L的固定密闭容器中,在500℃下进行反应,10min达到平衡,NH3的体积分数为ω.下列说法正确的是( )
2NH3(g);△H=-92.4kJ/mol现将1molN2和3molH2加入到2L的固定密闭容器中,在500℃下进行反应,10min达到平衡,NH3的体积分数为ω.下列说法正确的是( )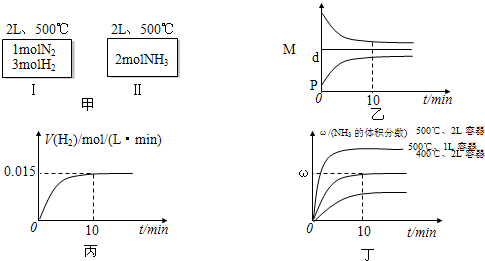
A.如甲图所示:Ⅰ、Ⅱ两种途径中达到平衡时,NH3的体积分数均为ω,且Ⅰ中放出的热量与Ⅱ中吸收的热量之和为92.4kJ
B.反应进程中,混合气体的平均相对分子质量(M)、混合气体的密度(d)、混合气体的压强(P)三者的变化趋势如图乙所示
C.若达到平衡时放出的热量为9.24kJ,则氢气的反应速度变化曲线如图丙所示
D.若起始加入的物料均为1molN2、3molH2,在不同条件下达到平衡时,NH3的体积分数变化曲线如丁图所示
-
25 ℃时,合成氨反应的热化学方程式为:N2 (g) +3H2 (g) 2NH3(g) ΔH=-92.4 kJ/mol
2NH3(g) ΔH=-92.4 kJ/mol
下列叙述正确的是
A. 混合气体的质量不变时,说明该反应一定达到平衡状态
B. 将容器的体积扩大到原来的二倍,υ(正)减小,υ(逆)增大,平衡向左移动
C. 催化剂既能提高N2的转化率,又能缩短达到平衡所需时间,提高生产效益
D. 在密闭容器中放入1 mol N2和3 mol H2进行反应,测得反应放出的热量小于92.4 kJ
-
25 ℃时,合成氨反应的热化学方程式为:
N2 (g) +3H2 (g)  2NH3(g) ΔH=-92.4 kJ/mol
2NH3(g) ΔH=-92.4 kJ/mol
下列叙述正确的是
A.混合气体的质量不变时,说明该反应一定达到平衡状态
B.将容器的体积扩大到原来的二倍,υ(正)减小,υ(逆)增大,平衡向左移动
C.催化剂既能提高N2的转化率,又能缩短达到平衡所需时间,提高生产效益
D.在密闭容器中放入1 mol N2和3 mol H2进行反应,测得反应放出的热量小于92.4 kJ
-
德国化学家哈伯(F.Haber)从1902年开始研究由氮气和氢气直接合成氨。合成氨为解决世界的粮食问题作出了重要贡献。其原理为N2(g)+3H2(g)⇌2NH3(g) △H=-92.4kJ/mol
(1)若已知H-H键的键能为436.0kJ/mol,N-H的键能为390.8kJ/mol,则N N的键能约为_____kJ/mol
N的键能约为_____kJ/mol
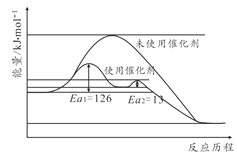
(2)合成氨反应不加催化剂很难发生,催化剂铁触媒加入后参与了反应降低了活化能。其能量原理如图所示,则加了催化剂后整个反应的速率由______决定(填“第一步反应”或者“第二步反应”),未使用催化剂时逆反应活化能______正反应活化能(填“大于”“小于”或者“等于”)
(3)从平衡和速率角度考虑,工业生产采取20MPa到50MPa的高压合成氨原因______
(4)一定温度下恒容容器中,以不同的H2和N2物质的量之比加入,平衡时NH3体积分数如图所示,则H2转化率a点______b点(填"大于”“小于”或者“等于”)。若起始压强为20MPa,则b点时体系的总压强约为______MPa。
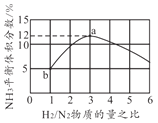
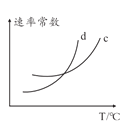
(5)若该反应的正逆反应速率分别表示为v正=K正 ,v逆=K逆∙c2(NH3),则一定温度下,该反应 的平衡常数K=______(用含K正和K逆的表达式表示),若K正和K逆都是温度的函数,且随温度升高而升高,则图中c和d分别表示______和______随温度变化趋势(填K正或者K逆)。
,v逆=K逆∙c2(NH3),则一定温度下,该反应 的平衡常数K=______(用含K正和K逆的表达式表示),若K正和K逆都是温度的函数,且随温度升高而升高,则图中c和d分别表示______和______随温度变化趋势(填K正或者K逆)。
(6)常温下,向20mL的0.1mol/L的盐酸中通入一定量氨气反应后溶液呈中性(假设溶液体积变化忽略不计)则所得溶液中c(NH4+)=_______
-
德国化学家哈伯从1902年开始研究由氮气和氢气直接合成氨。合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)  2NH3(g) △H=-92.4kJ·mol-1
2NH3(g) △H=-92.4kJ·mol-1
一种利用天然气合成氨的简易流程如下:
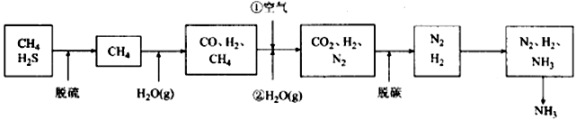
天然气先经脱硫,然后通过两次转化,再经过二氧化碳脱除等工序,得到氮氢混合气,进入氨合成塔,制得产品氨。
(1)根据化学平衡移动原理,为提高合成氨的生产效率,选择氨合成塔中适宜的生产条件是 。
(2)CH4与水蒸气制氢气的反应为CH4(g)+ H2O (g)  CO (g) +3H2(g),在2 L的密闭容器中,将物质的量各1 mol的CH4和H2O (g)混合反应,CH4的平衡转化率与温度、压强的关系如下图所示:
CO (g) +3H2(g),在2 L的密闭容器中,将物质的量各1 mol的CH4和H2O (g)混合反应,CH4的平衡转化率与温度、压强的关系如下图所示:
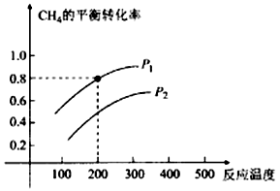
①该反应的△H 0(填﹥、﹤)。
②图中压强P1 P2(填﹥、﹤)。
③200℃时该反应的平衡常数K= (保留一位小数)。
(3)NH3经过催化氧化生成NO,以NO为原料通过电解的方法可以制备NH4NO3,其总反应是8NO+7H2O 3NH4NO3+2HNO3,试写出以惰性材料作电极的阴极反应式: ;阳极反应式: ;电解过程中需要补充一种物质才能使电解产物全部转化为NH4NO3,该物质是 。
3NH4NO3+2HNO3,试写出以惰性材料作电极的阴极反应式: ;阳极反应式: ;电解过程中需要补充一种物质才能使电解产物全部转化为NH4NO3,该物质是 。
-
德国化学家哈伯从1902 年开始研究由氮气和氢气直接合成氨,反应原理为:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ•mol-1
2NH3(g) △H=-92.4kJ•mol-1
(1)在恒温恒容条件下,向反应平衡体系中充入氮气,达到新平衡时,c(H2)将_________(填“增大”、“减小”、“不变”或“无法判断”,下同),c(N2)·c3(H2)将___________。
(2)工业上可用CH4与水蒸气制氢气:CH4(g)+H2O(g) CO(g)+3H2(g)。在200℃时2L的密闭容器中,将1molCH4和1mol H2O(g)混合,达平衡时CH4 的转化率为80%。则200℃时该反应的平衡常数K=______________(保留一位小数)。
CO(g)+3H2(g)。在200℃时2L的密闭容器中,将1molCH4和1mol H2O(g)混合,达平衡时CH4 的转化率为80%。则200℃时该反应的平衡常数K=______________(保留一位小数)。
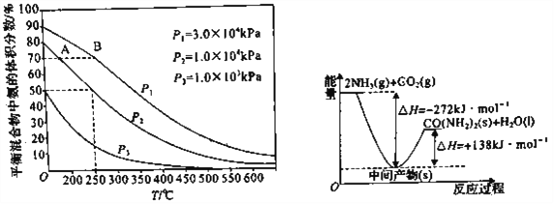
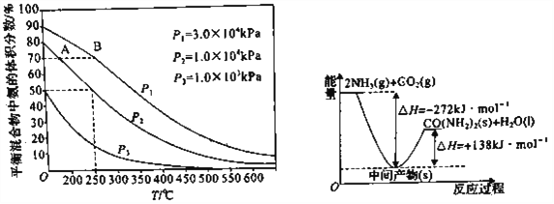
(3)如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3 时,平衡混合物中氨的体积分数。若分别用vA(NH3)和vB(NH3)表示从反应开始至达平衡状态A、B 时的化学反应速率,则vA(NH3)____ ( 填“>”“<”或“=”)vB(NH3)。
(4)工业生产中逸出的氨可用稀硫酸吸收。若恰好生成NH4HSO4,该溶液中各离子的物质的量浓度由大到小的顺序是______________________。
(5)H2NCOONH4是工业合成尿素的中间产物,该反应的能量变化如图所示,用CO2和氨合成尿素的热化学方程式为_________________________________。
-
德国化学家哈伯从1902 年开始研究由氮气和氢气直接合成氨,反应原理为:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ•mol-1
2NH3(g) △H=-92.4kJ•mol-1
(1)在恒温恒容条件下,向反应平衡体系中充入氮气,达到新平衡时,c(H2)将_________(填“增大”、“减小”、“不变”或“无法判断”,下同),c(N2)·c3(H2)将___________。
(2)工业上可用CH4与水蒸气制氢气:CH4(g)+H2O(g) CO(g)+3H2(g)。在200℃时2L的密闭容器中,将1molCH4和1mol H2O(g)混合,达平衡时CH4 的转化率为80%。则200℃时该反应的平衡常数K=______________(保留一位小数)。
CO(g)+3H2(g)。在200℃时2L的密闭容器中,将1molCH4和1mol H2O(g)混合,达平衡时CH4 的转化率为80%。则200℃时该反应的平衡常数K=______________(保留一位小数)。
(3)如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3 时,平衡混合物中氨的体积分数。若分别用vA(NH3)和vB(NH3)表示从反应开始至达平衡状态A、B 时的化学反应速率,则vA(NH3)____ ( 填“>”“<”或“=”)vB(NH3)。
(4)工业生产中逸出的氨可用稀硫酸吸收。若恰好生成NH4HSO4,该溶液中各离子的物质的量浓度由大到小的顺序是______________________。
(5)H2NCOONH4是工业合成尿素的中间产物,该反应的能量变化如图所示,用CO2和氨合成尿素的热化学方程式为_________________________________。
-
298K时,合成氨反应的热化学方程式为:
N2(g)+3H2(g)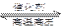 2NH3(g);△H=-92.4kJ·mol-1
2NH3(g);△H=-92.4kJ·mol-1
在该温度下,取1molN2和3molH2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量总是小于92.4 kJ是______________________________________________。
-
合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K= 。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越 。
(2)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K= (可用分数表示)。能说明该反应达到化学平衡状态的是 (填字母)。
a.容器内的密度保持不变
b.容器内压强保持不变
c.v正(N2)=2v逆(NH3)
d.混合气体中c(NH3)不变
(3)对于合成氨反应而言,下列有关图像一定正确的是(选填序号) 。
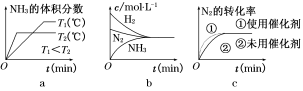
2NH3(g) △H=−92.4 kJ/mol。现将l mol N2(g)、3 mol H2(g)充入一容积为2 L的密闭容器中,在500℃下进行反应,10 min 时达到平衡,NH3的体积分数为
,下列说法中正确的是

,则容器I放出热量与容器II吸收热量之和为92.4 kJ

 2NH3(g) ΔH=-92.4 kJ/mol
2NH3(g) ΔH=-92.4 kJ/mol






 2NH3(g);△H=-92.4kJ·mol-1
2NH3(g);△H=-92.4kJ·mol-1