-
合成氨工业对国民经济和社会发展具有重要的意义。 合成塔中发生反应为: N2(g)+3H2(g)  2NH3(g) △H<0
2NH3(g) △H<0
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g)  CO2(g)+H2(g) △H>0
CO2(g)+H2(g) △H>0
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,
体系中c(H2)=0.12mol·L-1。
该温度下此反应的平衡常数K =________。
②保持温度不变,向上述平衡体系中再加入0.1mol CO,当反应重新建立平衡时,
水蒸气的总转化率α (H2O)________。
(2)下表为不同温度下合成氨反应的平衡常数。由表可推知T1 573K(填“>”、“<”或“=”)。
| T/K | T1 | 573 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
(3)673K,30MPa下n(NH3) 和n(H2) 随时间变化的关系如下图所示依据上图,下列有关叙述正确的是(填写序号)________。
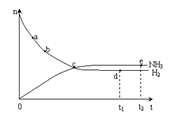
A.c点表示n(NH3)和n (H2)相等
B.c点表示NH3生成速率与NH3分解速率相同
C.e点和d点时反应的平衡常数相同
D.c点时正反应速率大于逆反应速率
(4)用NO2溶于水制硝酸:3NO2+H2O 2HNO3+NO。从生产流程看,吸收塔中需
2HNO3+NO。从生产流程看,吸收塔中需
要补充空气,其原因用化学平衡移动的理论进行解释是 ________
。
(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索
利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:
________。
-
合成氨工业对国民经济和社会发展具有重要的意义. 合成塔中发生反应为:
N2(g)+3H2(g)⇌2NH3(g)△H<0
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g)⇌CO2(g)+H2(g)△H>0
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下此反应的平衡常数K=______.
②保持温度不变,向上述平衡体系中再加入0.1mol CO,当反应重新建立平衡时,水蒸气的总转化率α (H2O)______.
(2)下表为不同温度下合成氨反应的平衡常数.由表可推知T1______573K(填“>”、“<”或“=”).
| T/K | T1 | 573 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
(3)673K,30MPa下n(NH3) 和n(H2) 随时间变化的关系如图所示依据上图,下列有关叙述正确的是(填写序号)______.
A.c点表示n(NH3)和n (H2)相等
B.c点表示NH3生成速率与NH3分解速率相同
C.e点和d点时反应的平衡常数相同
D.c点时正反应速率大于逆反应速率
(4)用NO2溶于水制硝酸:3NO2+H2O⇌2HNO3+NO.从生产流程看,吸收塔中需要补充空气,其原因用化学平衡移动的理论进行解释是______.
(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:______.
-
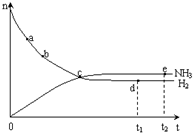
合成氨工业对国民经济和社会发展具有重要的意义,对密闭容器中的反应:N2(g)+3H2(g)  2NH3(g) △H<0。400℃、30MPa下n(NH3)和n(H2)随时间变化的关系如图,下列叙述错误的是( )
2NH3(g) △H<0。400℃、30MPa下n(NH3)和n(H2)随时间变化的关系如图,下列叙述错误的是( )

A.点a的正反应速率比b点的大
B.点c处反应还未达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,500℃下反应至t1时刻,n(H2)比右图中d点的值大
-
合成氨工业对国民经济和社会发展具有重要的意义,其原理是:
N2(g)+3H2(g)⇌2NH3(g) △H=-92.4KJ/mol,
(1)已知合成氨反应在某温度下2L的密闭容器中进行,测得数据如下表:
| 不同时间各物质的物质的量/mol |
| 0min | 1min | 2min | 3min | 4min |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
| | | | | |
根据表中数据计算:
①0 min~1 min内N2的平均反应速率为_____________
②该条件下反应的平衡常数k=________(保留两位小数)
③反应达到平衡后,若往平衡体系中再加入N2、H2、NH3各1mol,化学平衡向___________(填“正向”、“逆向”或“不移动”),该反应的平衡常数k___________(填“变大”“减小”或“不变”)
④能表明该反应达到平衡状态的是__________(选填序号)
A.N2的转化率等于NH3的产率
B.混合气体的平均相对分子质量不变
C.v(N2)与v(H2)的比值不变
D.混合气体的密度不变
(2)室温下向10mL0.3mol/LNaOH溶液中加入0.3mol/L的一元酸HA溶液pH的变化曲线如图,下列说法正确的是__________。
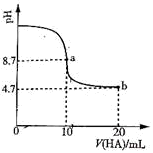
A.a点所示溶液中c(Na+)>c(A—)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.b点所示溶液中c(A-)>c(HA)
D.pH=7时,c(Na+)= c(A-)+ c(HA)
E.b点所示溶液中c(HA)+c(A-)=0.2mol/L
-
(9分)合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g),500 K、30 MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示。
2NH3(g),500 K、30 MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示。
请回答下列问题:
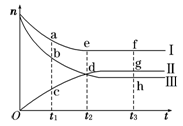
(1)上图中属于氢气物质的量随时间变化的曲线是 (填“Ⅰ”、“Ⅱ”或“Ⅲ”)。
(2)关于t2时刻的说法正确的是____________。
A.t2时该反应达到平衡状态
B.t2时Ⅱ和Ⅲ代表的物质反应速率相同
C.t2时氢气、氮气与氨气的反应速率之比为3∶1∶2
D.t2时氨气与氢气的物质的量相同
(3)对于Ⅱ所代表的物质,其逆反应速率最大的点是___________(填“c”、“d”或“g”);对于Ⅰ所代表的物质,其正反应速率最小的点是_____________(填“a”、“e”或“f”)。
(4)其他条件不变,只改变温度,在改变的这个温度下反应至t3时刻,此时n(H2)比图象中的值大,那么该温度可能是 。
A.673 K B.273 K C.373 K
(5)在密闭容器中充入2 mol N2和6 mol H2,一定条件下建立平衡:N2(g)+3H2(g)  2NH3(g) ΔH=-92.2 kJ/mol,测得N2的转化率为90%,则在此条件下,反应放出的热量为 kJ。若与上述反应的温度和体积相同时,向密闭容器中充入4 mol NH3,则达平衡后,反应 (填“放出”或“吸收”)的热量为 kJ。
2NH3(g) ΔH=-92.2 kJ/mol,测得N2的转化率为90%,则在此条件下,反应放出的热量为 kJ。若与上述反应的温度和体积相同时,向密闭容器中充入4 mol NH3,则达平衡后,反应 (填“放出”或“吸收”)的热量为 kJ。
-
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g) + 3H2(g)  2NH3(g),500K、30MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示。请回答下列问题:
2NH3(g),500K、30MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示。请回答下列问题:
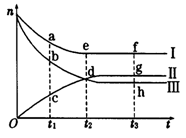
(1)上图中属于氢气物质的量随时间变化的曲线是_____________(填“I”、“II”或“Ⅲ”)。
(2)关于t2时刻的说法正确的是______。
A.t2时该反应达到平衡状态 b.t2时II和III代表的物质反应速率相同
c.t2时氢气、氮气与氨气的反应速率之比为3:1:2 D.t2时氨气与氢气的物质的量相同
(3)对于II所代表的物质,其逆反应速率最大的点是__________(填“c”、“d”或“g”);对于I所代表的物质,其正反应速率最小的点是___________ (填“a”、“e”或“f”)。
(4)其他条件不变,只改变温度,在改变的这个温度下反应至t3时刻,此时n(H2)比图象中的值大,那么该温度可能是____________(填序号)。
A.673 K B.273 K C.373 K
(5)在密闭容器中充入2 mol N2和6 mol H2,—定条件下建立平衡:N2(g) + 3H2(g)  2NH3(g) △H=-92.2kJ/mol,测得 N2 的转化率为 90%,则在此条件下,反应放出的热量为___________kJ。若与上述反应的温度和体积相同时,向密闭容器中充入4 mol NH3,则达平衡后,反应_________(填“放出”或“吸收”)的热量为___________kJ。
2NH3(g) △H=-92.2kJ/mol,测得 N2 的转化率为 90%,则在此条件下,反应放出的热量为___________kJ。若与上述反应的温度和体积相同时,向密闭容器中充入4 mol NH3,则达平衡后,反应_________(填“放出”或“吸收”)的热量为___________kJ。
-
合成氨工业对国民经济和社会发展具有重要意义,对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g)+Q
2NH3(g)+Q
(1)写出该反应的逆反应的化学平衡常数表达式_____,升高温度,该反应化学反应速率_____,氢气的转化率____(以上均填“增大”、“减小”或“不变”)。实际生产中温度一般控制在500℃,原因是__________。
(2)能表示该反应在恒温恒容密闭容器中t1时刻后已经达到平衡状态的图示是________。
(3)浓度0.1mol/L的氨水,pH为11。当用蒸馏水稀释100倍时,则NH3·H2O的电离平衡将向______方向移动(填“正”或“逆”),溶液的pH将为____9(“大于”“小于”“等于”)。设计一个简单实验,证明一水合氨是弱碱:____________。
-
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)
 2NH3(g)(正反应为放热反应),673K、30MPa下,n(NH3)和n(H2)随时间 t变化的关系如图所示.下列叙述中,正确的是( )
2NH3(g)(正反应为放热反应),673K、30MPa下,n(NH3)和n(H2)随时间 t变化的关系如图所示.下列叙述中,正确的是( )
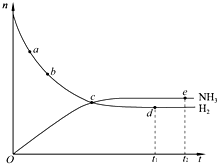
A.点c处正反应速率和逆反应速率相等
B.点a的正反应速率比点b的大
C.点d(t1时刻)和点e(t2时刻)处n(N2)不同
D.在t2时刻,正反应速率大于逆反应速率
-
合成氨工业对国民经济和社会发展具有重要的意义,对密闭容器中的反应:
N2(g)+3H2(g) 2NH3(g) ;△H< 0 。 400℃、30MPa下n(NH3)和n(H2)随时间变化的关系如图,下列叙述错误的是( )
2NH3(g) ;△H< 0 。 400℃、30MPa下n(NH3)和n(H2)随时间变化的关系如图,下列叙述错误的是( )
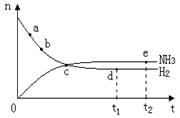
A.点a的正反应速率比b点的大
B.点c处反应还未达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,500℃下反应至t1时刻, n(H2)比右图中d点的值大
-
合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K= 。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越 。
(2)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K= (可用分数表示)。能说明该反应达到化学平衡状态的是 (填字母)。
a.容器内的密度保持不变
b.容器内压强保持不变
c.v正(N2)=2v逆(NH3)
d.混合气体中c(NH3)不变
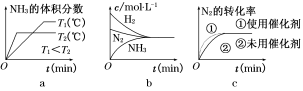
(3)对于合成氨反应而言,下列有关图像一定正确的是(选填序号) 。
2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:








