-
煤和石油是两种重要的能源,下列说法正确的是
A. 液化石油气、汽油和石蜡的主要成分都是碳氢化合物
B. 煤经气化和液化两个物理变化过程,可变为清洁能源
C. 石油裂解和油脂皂化都是高分子生成小分子的过程
D. 工业上获得大量的乙烯和丙烯的方法是石油裂化
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 在1.0 L 1.0 mol/L的NaAlO2溶液中,含有的氧原子数目为2NA
B. 1molSO2与足量O2在一定条件下反应生成SO3,转移电子数目为2NA
C. 0.lmolNa2O2与足量的潮湿的CO2反应转移的电子数目为0.lNA
D. 电解精炼铜时,若阳极质量减少32g,则阴极转移电子的数目为NA
难度: 中等查看答案及解析
-
分子式为C8H11N的有机物中,含有苯环且苯环上有二个侧链的同分异构体数目(不考虑立体异构)为
A. 3 B. 6 C. 9 D. 12
难度: 中等查看答案及解析
-
除去下列物质中所含少量杂质的设计正确的是
选项
物质
杂质
试剂
提纯方法
A
BaSO4
BaCO3
盐酸
溶解、过滤、洗涤
B
CO2
SO2
饱和Na2CO3溶液
洗气
C
乙酸乙酯
乙酸
稀NaOH溶液
混合振荡、静置分液
D
蛋白质
葡萄糖
浓(NH4)2SO4溶液
盐析、过滤、洗涤
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X 的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是
A. 简单离子半径: W<X<Z
B. W与X形成的化合物溶于水后溶液呈碱性
C. 气态氢化物的热稳定性:W<Y
D. 最高价氧化物的水化物的酸性:Y>Z
难度: 中等查看答案及解析
-
常温下,Ka1(H2C2O4)=10-1.3,Ka2(H2C2O4)=10-4.2。用0.l000mol/L NaOH溶液滴定10.00 mL 0.l000mol/L H2C2O4溶液所得滴定曲线如图。下列说法正确的是

A. 点①所示溶液中:

B. 点②所示溶液中:
C. 点③所示溶液中:
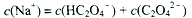
D. 点④所示溶液中:
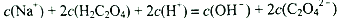
难度: 困难查看答案及解析
-
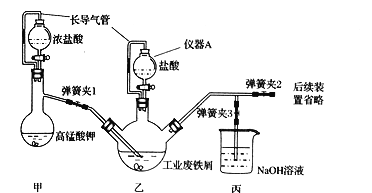
根据下列实验操作和现象得出的相关结论正确的是

A. A B. B C. C D. D
难度: 困难查看答案及解析
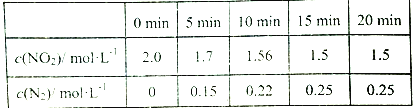
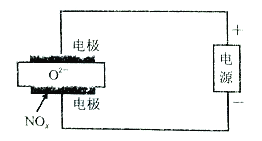
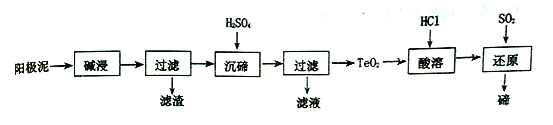
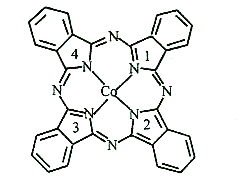

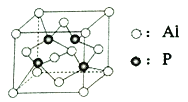
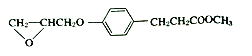 以有机物A为原料合成X的流程如图所示(部分条件省略):
以有机物A为原料合成X的流程如图所示(部分条件省略):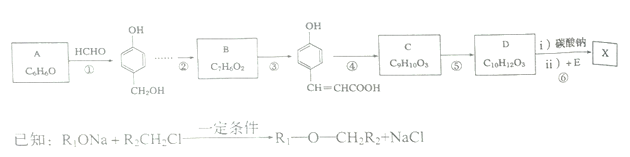
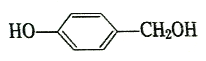 可制备某线性结构高分子酚醛树脂,该反应的化学方程式为____。
可制备某线性结构高分子酚醛树脂,该反应的化学方程式为____。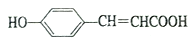 的同分异构体有____种。
的同分异构体有____种。