-
生活中的某些问题常常涉及化学知识.下列叙述正确的是( )
A.合金材料中不可能含有非金属元素
B.汽油、柴油和植物油都是碳氢化合物
C.日本福岛核电站爆炸时释放的两种放射性核素I与
Cs的中子数相等
D.明矾溶于水生成的Al(OH)3胶体,可除去水中的悬浮颗粒杂质难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.CaCO3在水中溶解度很小,其水溶液导电性很弱,所以CaCO3是弱电解质
B.A原子的最外层电子数比B原子多,则A单质的氧化性一定比B单质强
C.A+和B-的电子层结构相同,则A原子的核电荷数比B原子的大
D.任何宏观物质都是由微观粒子构成,而这些粒子之间又都存在着化学键难度: 中等查看答案及解析
-
下列关于有机物的叙述不正确的是( )
A.甲烷、乙烯和苯都可通过石油分馏得到
B.油脂在碱的作用下可发生水解,工业上利用该反应生产肥皂
C.用灼烧并闻气味的方法可以区分纯棉织物和纯毛织物
D.钠跟水反应比跟乙醇反应剧烈难度: 中等查看答案及解析
-
下列有关实验操作的叙述正确的是( )
A.用过滤法分离氢氧化铁胶体和三氯化铁溶液的混合物
B.将5.85gNaCl固体溶于1OOOmL容量瓶中,加水定容后即可制得O.1mol•L-1 的NaCl溶液
C.向含有少量Ca(OH)2的Mg(OH)2悬浊液中加入饱和MgCl2溶液,充分搅拌后过滤,洗涤,可达到除去Mg(OH)2中的少量Ca(OH)2的目的
D.精炼铜时,粗铜做阴极,纯铜做阳极,电解质溶液为CuSO4溶液难度: 中等查看答案及解析
-
下列有关元素及其化合物的说法错误的是( )
A.Na2O和Na2O2组成元素相同,化学性质也相同
B.往FeCl3溶液中滴入KI-淀粉溶液,溶液变蓝色
C.Si、P、S、Cl的得电子能力及其最髙价氧化物对应水化物的酸性均依次堉强
D.在常温下,浓硫酸、浓硝酸与铁均可发生钝化,故能用铁罐储运难度: 中等查看答案及解析
-
X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的 原子序数之和为16.在适当条件下三种单质两两化合,可发生如图所示变化.己知1个B分子中含有Z元素的原子个数比C分子中含有Z元素的原子个数少1个.下面判断正确的是( )
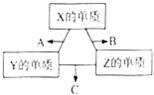
A.原子半径:Z<Y<X
B.非金属性:Z>Y>X
C.化合物A易溶于水
D.化合物B与C的混合物呈碱性难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.对于平衡体系:H2(g)+I2(g)═2HI(g),其它条件不变时,增大体系压强,平衡向正反应方向移动,体系颜色加深
B.-定温度下,物质的量浓度相同的4种溶液①CH3COONa②NaNO3 ③Na2CO3 ④NaOH,pH的大小顺序是④>③>①>②
C.O.1mol•L-1的氨水加水稀释后,NH3•H20的电离程度增大,c(OH-)增大,c(H+)减小
D.常温下,的溶液中:Na+、Al3+、SO42-、NO3-可大量共存
难度: 中等查看答案及解析