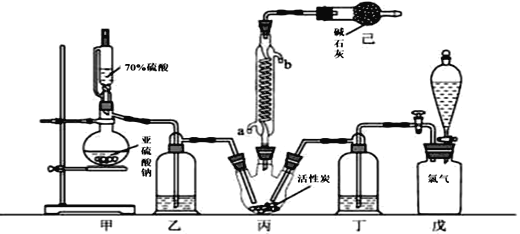
-
习主席在十九大报告中说:“绿水青山就是金山银山。”而我们乌兰察布冬天的“冰雕雪山也是金山银山”。但这需要保护好我们的环境。下列做法不利于保护环境的是
A. 冬季集中供暖 B. 节约用纸或尽量使用再生纸
C. 将电池深埋 D. 控制畜牧放养以增加植被面积
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A. V L a mol/L的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目大于3NA
B. 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g
C. 40gSiC晶体中含有SiC分子的数目为NA
D. 标准状况下,将22.4LNO和11.2LO2混合后,可以得到NA个NO2分子
难度: 简单查看答案及解析
-
下列物质的转化在给定条件下能实现的是( )
①Al2O3
NaAlO2(aq)
Al(OH)3
②S
SO3
H2SO4
③饱和NaCl(aq)
NaHCO3
Na2CO3
④Fe2O3
FeCl3(aq)
无水FeCl3
⑤MgCl2(aq)
Mg(OH)2
MgO
A. ②③④ B. ①③⑤ C. ②④⑤ D. ①④⑤
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是( )

A. 由图甲可知,a点Kw的数值比b点Kw的数值大
B. 乙表示在相同的密闭容器中,不同温度下的反应,该反应的ΔH>0
C. 丙表示0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1醋酸溶液的滴定曲线
D. 根据图丁,除去CuSO4溶液中的Fe3+,可加入CuO调节pH至3~4
难度: 中等查看答案及解析
-
1mol分子式为C5H10O3的有机物,与NaHCO3溶液充分反应时,生成CO2的体积为22.4L(气体体积均在标准状况下测得),与足量的金属钠充分反应时,生成H2的体积仍然为22.4L,则该有机物的同分异构体(不考虑立体异构)有( )种
A. 13 B. 12 C. 11 D. 10
难度: 中等查看答案及解析
-
下列有关图示分析正确的是( )
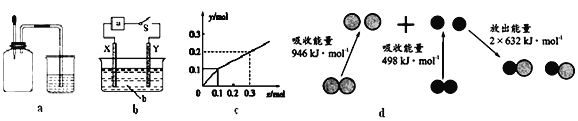
A. 如图a所示,集气瓶内充满Cl2和CH4的混合气体或NO2和O2的混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,并全部充满集气瓶
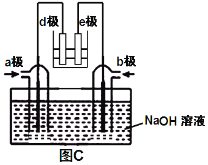
B. 如图b所示,X为铁棒,Y为铜棒,a为直流电源,当S闭合后,当b为NaOH溶液,X极附近产生白色沉淀时,电子从X极流入a
C. Pt为电极,电解含0.10 mol M+和0.1 mol N3+(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图c,离子氧化能力M+>N3+>H+
D. 图d为N2(g)和O2(g)生成NO(g)过程中的能量变化,则N≡N的键能为946kJ/mol,热化学方程式为:N2(g)+O2(g)=2NO(g) ΔH=-180 kJ/mol
难度: 中等查看答案及解析
-
混合动力车在刹车和下坡时处于充电状态;上坡或加速时,电动机提供辅助推动力,降低了汽油的消耗。该车一般使用的是镍氢电池采用镍的化合物和储氢金属(以M表示)为两电极材料,碱液(主要为KOH)电解液。镍氢电池充放电原理如图,其总反应式为:H2+2NiOOH = 2Ni(OH)2 下列有关判断正确的是( )
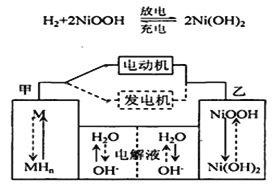
A. 在上坡或加速时,溶液中的K+向甲电极迁移
B. 在刹车和下坡时,甲电极的电极反应式为:2 H2O+2e- H2↑+2OH-
C. 在上坡或加速时,乙电极周围溶液的pH将减小
D. 在刹车和下坡时,乙电极增重
难度: 中等查看答案及解析
-
有关氧化还原反应的理解正确的是( )
A. 在一定条件下,氯酸钾与碘发生反应KClO3+I2=2KIO3+Cl2 由此判断氧化性 I2>Cl2
B. 已知反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O其中1mol氧化剂在反应中得到的电子为12 mol
C. (NH4)2SO4在高温下分解生成 SO2、H2O、N2和 NH3。则该反应的氧化产物与还原产物的物质的量比为1:3
D. 在反应CH3CH2OH+K2Cr2O7(H+)→CH3COOH中,每消耗1mol乙醇转移3NA个电子(NA为阿伏伽德罗常数的值)
难度: 中等查看答案及解析
-
在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断正确的是( )
A. 在含等物质的量的AlO2-、OH-、CO32--的溶液中,逐滴加入盐酸:AlO2-、OH-、CO32-
B. 在含等物质的量的Fe3+、Cu2+、H+的溶液中加入锌粉:Fe3+、Cu2+、H+、Fe2+
C. 在含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2: KOH、Ba(OH)2、K2CO3、BaCO3
D. 在含等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:I-、Br-、Fe2+
难度: 中等查看答案及解析
-
下列①、②对应的试剂(或条件)不能完成实验目的的是 ( )
实验目的
试剂(或条件)
A
温度对Na2S2O3与H2SO4反应速率的影响
①热水浴 ②冷水浴
B
用酸化的AgNO3溶液检验自来水中Cl-是否蒸馏除去
①自来水 ②蒸馏水
C
用Na块检验乙醇分子存在不同于烃分子里的氢原子
①乙醇 ②煤油
D
用溴水检验苯的同系物中取代基对苯基活性有影响
①苯 ②甲苯
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):A2(g)+3B2(g)
2AB3(g) ΔH<0,相关数据如下表所示:
容器
甲
乙
丙
相关条件
恒温恒容
绝热恒容
恒温恒压
反应物投料
1mol A2、3molB2
2molAB3
2mol AB3
反应物的转化率
a甲
a乙
a丙
反应的平衡常数K=
K甲
K乙
K丙
平衡时AB3的浓度/mol·L-1
c甲
c乙
c丙
平衡时AB3的反应速率/mol·L-1·min-1
V甲
v乙
v丙
下列说法正确的是( )
A. K乙<K丙 B. c乙=c丙 C. a甲 +a乙<1 D. v甲=v丙
难度: 困难查看答案及解析
-
短周期主族元素 X、Y、Z、W的原子序数依次增大,四种元素形成的单质依次为m、n、p、q;r、t、u 是这些元素组成的二元化合物,其中u为葡萄酒中的抑菌成分;25 ℃,0.01 mol/L的v溶液中:
= 1.0×10-10。上述物质的转化关系如图所示,下列说法正确的是( )
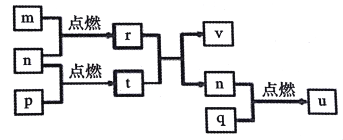
A. 简单离子半径:W>Z>Y>X
B. W,Y分別与X元素形成的简单化合物的沸点: W> Y
C. Z2Y和ZX中存在的化学键类型相同
D. v能抑制水的电离,u能促进水的电离
难度: 中等查看答案及解析
-
C和CuO在一定温度下反应,产物有Cu、Cu2O、CO 、CO2。若将2.00gC与16.0gCuO混合,隔绝空气加热,将生成的气体全部通入足量的澄清石灰水,反应一段时间后共收集到1.12 L (标准状况)气体,生成沉淀的质量为5.00 g。下列说法不正确的是
A. 反应后的固体混合物中Cu的质量为12. 8 g
B. 反应后的固体混合物中含有碳
C. 反应后的固体混合物总质量为14. 4 g
D. 反应后的固体混合物中氧化物的物质的量为0.05 mol
难度: 困难查看答案及解析
-
在常温下,0.100 0 mol·L-1Na2CO3溶液25 mL用0.1000 mol·L-1盐酸滴定,滴定曲线如图。对滴定过程中所得溶液中相关离子浓度间的关系,下列说法正确的是( )
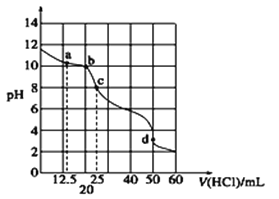
A. a点:c(CO32-)>c(HCO3-)>c(OH-)
B. b点:5c(Cl-)>4c(HCO3-)+4c(CO32-)
C. c点:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D. d点:c(H+)>2c(CO32-)+c(HCO3-)+c(OH-)
难度: 困难查看答案及解析