-
在生产、生活中,下列物质起到氧化作用的是
A. 甘油用作护肤保湿剂
B. 高锰酸钾溶液用于水果保鲜
C. 铁粉用作食品袋中的脱氧剂
D. 浓盐酸用于检验输送氨气管道是否漏气
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的数值,下对说法正确的是
A. 标准状况下22.4 L甲苯含有8NA个C-H键
B. 1L1 mol·L-1的Na2S溶液中含有NA个S2-
C. 46gNa与足量H2O反应完全后可生成NA个H2分子
D. 1molCu和少量浓硝酸反应完全后可生成2NA个NO2分子
难度: 中等查看答案及解析
-
下列有关氯化铁溶液的性质所涉及的离子方程式不正确的是
A. 用作净水剂: Fe3++3H2O
Fe(OH)3+3H+
B. 用于制印刷电路的腐蚀液:2Fe3++Cu = 2Fe2++Cu2+
C. 与小苏打溶液反应: Fe3++3HCO3-=Fe(OH)3↓+3CO2↑
D. 遇KSCN 溶液变红色:Fe3++3SCN-= Fe(SCN)3↓
难度: 中等查看答案及解析
-
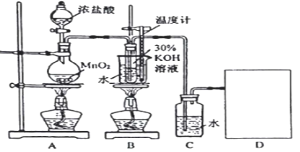
欲用下图装置对所制备的气体进行除杂、检验,其设计方案合理的是
制备气体
X(除杂试剂)
Y (检验试剂)
A
CH3CH2Br与NaOH乙醇溶液共热
H2O
KMnO4酸性溶液
B
电石与NaCl水溶液
H2O
Br2的CCl4溶液
C
C2H5OH与浓硫酸
加热至170℃
饱和NaHSO3
溶液
K2Cr2O7酸性溶液
D
生石灰与浓氨水
浓硫酸
红色石蕊试坻
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
有关如下反应的叙述正确的是
I :C(g)+H2O(g)
CO(g)+H2(g) △H=+131.0kJ/mol
II: CO(g) +H2O(g)
CO2(g) + H2(g) △H=-43kJ/mol
III: CaO(s) + CO2(g)
CaCO3(s) △H =-178.3 kJ/mol
IV: C(s)+2H2O(g)+CaO(s)
CaCO3(s)+2H2(g) △H=akJ/mol
A. a=+90.3
B. 恒温恒压下,在己达平衡的反应I体系中再充入少量He时平衡正向移动
C. 其他条件不变,加压对反应Ⅱ的反应速率无影响
D. 其他条件不变,升高温度可提高反应Ⅲ中CO2的转化率
难度: 中等查看答案及解析
-
己知:图1中a和b分别为常温下盐酸和NaOH溶液互滴的pH变化曲线;图2为常温下CaSO4在水中的沉淀溶解平衡曲线[Ksp(CaSO4)=9×10-6]。下列相关叙述正确的是
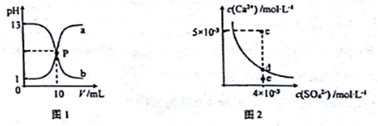
A. 图1中P点溶液:c(Na+)= c(Cl-)>c(H+) = c(OH-)
B. 由图1可知盐酸和NaOH溶液的浓度均为1mol·L-1
C. 图2中c点有沉淀生成,达平衡后溶液中c(SO42-)=3×10-3 mol·L-1
D. 可通过蒸发将图 2中e点的溶液变到d点
难度: 困难查看答案及解析

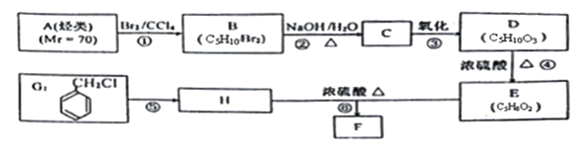
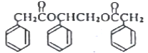 。________________(在方框内写中间体的结构简式,在“→”上方或下方写反应所需条件或试剂)
。________________(在方框内写中间体的结构简式,在“→”上方或下方写反应所需条件或试剂)