-
化学是你,化学是我,化学深入我们生活,下列说法正确的是( )
A.木材纤维和土豆淀粉遇碘水均显蓝色
B.食用花生油和鸡蛋清都能发生水解反应
C.包装用材料聚乙烯和聚氯乙烯都属于烃
D.PX项目的主要产品对二甲苯属于饱和烃
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A、2.0gH218O与D2O的混合物中所含中子数为NA
B、常温常压下4.4g乙醛所含σ键数目为0.7NA
C、标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA
D、50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
难度: 中等查看答案及解析
-
下列有关Fe2(SO4)3溶液的叙述正确的是 ( )
A.该溶液中,K+、Fe2+、C6H5OH、Br- 可以大量共存
B.和KI溶液反应的离子方程式:Fe3++2I -= Fe2++I2
C.和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-=Fe(OH)3↓+BaSO4↓
D.1L 0.1mol·L-1该溶液和足量的Zn充分反应,生成11.2g Fe
难度: 中等查看答案及解析
-
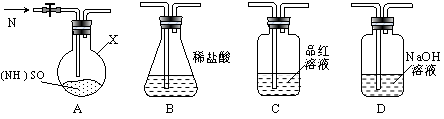
下列实验中,所使用的装置(夹持装置略)、试剂和操作方法都正确的是( )
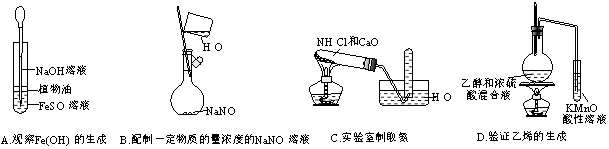
难度: 中等查看答案及解析
-
a.b.c.d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c。下列叙述错误的是
A.d元素的非金属性最强
B.它们均存在两种或两种以上的氧化物
C.只有a与其他元素生成的化合物都是离子化合物
D.b.c.d与氢形成的化合物中化学键均为极性共价键
难度: 中等查看答案及解析
-
室温下,在0.2 mol·L-1 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列有关说法正确的是 ( )
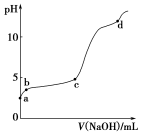
A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为 Al3++3OH-
Al(OH)3
B.a~b段,溶液pH增大,Al3+浓度不变
C.b~c段,加入的OH-主要用于生成Al(OH)3沉淀
D.d点时,Al(OH)3沉淀开始溶解
难度: 中等查看答案及解析
-
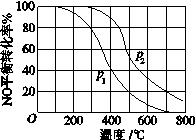
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol·L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如右图。据图分析,下列判断不正确的是( )
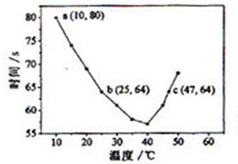
A.40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反
B.图中b、c两点对应的NaHSO3反应速率相等
C.图中a点对应的NaHSO3反应速率为5.0 ×10-5mol·L-1·s-1
D.温度高于40℃时,淀粉不宜用作该试验的指示剂
难度: 极难查看答案及解析
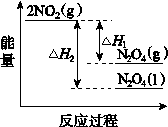
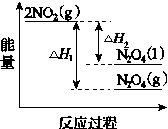
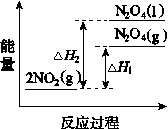
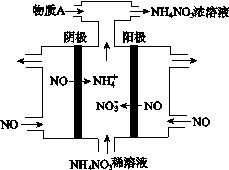

 RCH=CHCOOR′
RCH=CHCOOR′