-
化学与新型材料、环境保护、能源开发等密切相关。下列说法错误的是
A.人造纤维、合成橡胶和光导纤维都属于有机高分子化合物
B.使用生物酶降解生活废水中的有机物,可防止水体的富营养化
C.上海世博会很多展馆采用光电转化装置,体现当今“低碳”经济的理念
D.利用二氧化碳等原料合成聚碳酸酯类可降解塑料,有利于减少白色污染
难度: 中等查看答案及解析
-
下列有关化学用语或名称表达正确的是
A.亚硫酸的电离方程式:H2SO3
2H++SO32-
B.乙炔的分子结构模型示意图:
C.H2O2的电子式:
D.
的名称3-甲基-1-丁醇
难度: 中等查看答案及解析
-
下列有关物质的性质和该性质的应用均正确的是
A.SO2具有氧化性,可用于漂白纸浆
B.炭具有还原性,一定条件下能将二氧化硅还原为硅
C.BaCO3、BaSO4都难溶于水,均可用做钡餐
D.Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A.pH=1的溶液中:Fe3+、Cl-、NO3-、K+
B.滴入酚酞显红色的溶液中:Na+、Mg2+、AlO2-、NO3-
C.加入铝粉产生H2的溶液中:Fe2+、Na+、SO42-、ClO-
D.c(SO32-)=0.1 mol·L-1的溶液中:Na+、Cl-、H+、Ca2+
难度: 中等查看答案及解析
-
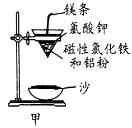
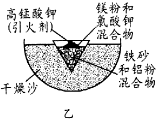
下列有关实验装置的说法中正确的是
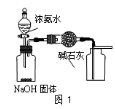
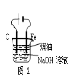
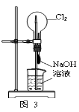
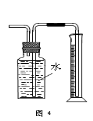
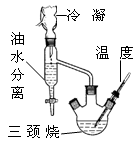
A.用图1装置制取干燥纯净的NH3
B.用图2装置实验室制备Fe(OH)2
C.用图3装置可以完成“喷泉”实验
D.用图4装置测量Cu与浓硝酸反应产生气体的体积
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.0.1 mol Cl2全部溶于水后转移电子的数目为0.1NA
B.标准状况下,0.56 L丙烷中含有共价键的数目为0.2NA
C.25℃时,1 L pH=12的Na2CO3溶液中含有Na+的数目为0.02NA
D.常温常压下,14 g C2H4、C3H6的混合气体中含有碳原子的数目为NA
难度: 中等查看答案及解析
-
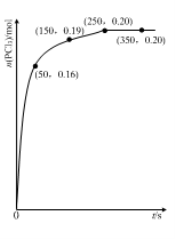
下表各组物质中,物质之间不可能实现如图所示转化的是
选项
X
Y
Z
M
A
NH3
NO
NO2
O2
B
Cl2
FeCl3
FeCl2
Fe
C
Al
Al(OH)3
NaAlO2
NaOH
D
NaOH
Na2CO3
NaHCO3
CO2
难度: 中等查看答案及解析
-
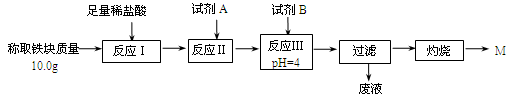
下列说法中用离子方程式表达正确的是
A.用惰性电极电解氯化钠溶液:2Cl-+2H+
H2↑+Cl2↑
B.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3 ↓+CO32-
C.Fe(NO3)2 溶液中滴加少量稀盐酸:Fe2++NO3-+4H+=Fe3++NO↑+2H2O
D.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-= CaCO3↓+H2O
难度: 中等查看答案及解析
-
下列说法不正确的是
A.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
B.加热、蒸发MgCl2饱和溶液可得无水MgCl2晶体
C.工业上用石灰乳对煤燃烧后形成的烟气进行脱硫,最终能制得石膏
D.室温下,c(NH4+)相等的(NH4)2SO4、NH4HCO3、NH4Cl溶液中:c(NH4)2SO4<c(NH4Cl)<c(NH4HCO3)
难度: 中等查看答案及解析
-
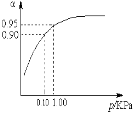
下列图示与对应的叙述相符的是
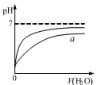
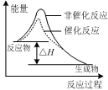
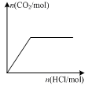
图甲 图乙 图丙 图丁
A.由图甲表示的反应速率随温度变化的关系可知该反应的ΔH>0
B.图乙表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是醋酸
C.图丙表示该反应为放热反应,且催化剂能改变反应的焓变
D.图丁表示向Na2CO3溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸物质的量的关系
难度: 中等查看答案及解析
-
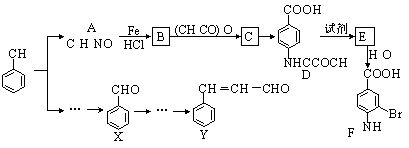
某有机物Z具有较广泛的抗菌作用,其生成机理可由X与Y相互作用:
X Z
下列有关叙述中不正确的是
A.Z结构中有4个手性碳原子
B.Y的分子式为C9H8O3
C.1 mol Z与足量NaOH溶液反应,最多消耗8 mol NaOH
D.Z与浓溴水既能发生取代反应又能发生加成反应
难度: 中等查看答案及解析
-
X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如图所示。Z元素原子核外K层与M层电子数相等。下列说法中正确的是
X
Y
Z
W
A.Y元素最高价氧化物对应的水化物化学式为H2YO3
B.原子半径由小到大的顺序为:Y<X<W<Z
C.室温下,Z和W的单质均能溶于浓硝酸
D.X、Z两种元素的氧化物中所含化学键类型相同
难度: 中等查看答案及解析
-
下列实验操作、现象与结论对应关系正确的是
选项
实验操作
实验现象
结论
A
向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1 H2SO4溶液
试管口出现红棕色气体
溶液中NO3-被Fe2+还原为NO2
B
向溶液中先滴加稀盐酸,再滴加BaCl2溶液
先滴加稀盐酸无现象,滴加BaCl2后出现白色沉淀
溶液中一定含有SO42-
C
在0.1 mol·L-1 Na2CO3溶液中,加两滴酚酞显浅红色,微热
红色加深
盐类水解是吸热反应
D
向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热
无砖红色沉淀生成
淀粉没有水解生成葡萄糖
难度: 中等查看答案及解析
-
25℃时,有c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示。下列有关溶液中离子浓度关系的叙述正确的是
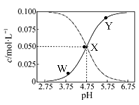
A.Y点所表示的溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)
B.W点所表示的溶液中:c(Na+)+c(H+)+c(OH-)+c(CH3COOH)=0.1mol·L-1
C.该温度下醋酸的电离平衡常数为10—4.75 mol·L-1
D.向X点所表示的溶液中加入等体积的0.05 mol·L-1 NaOH溶液 :c(H+)=c(CH3COOH)+c(OH-)
难度: 中等查看答案及解析