-
化学是一门实用的中心学科,生活中的许多问题常涉及到化学.下列有关化学知识叙述正确的是( )
A.制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型有机高分子材料,糖类、蛋白质、氨基酸、纤维素都是天然高分子化合物
B.化工生产:氯碱工业、硫酸工业、普通玻璃工业、合成氨工业过程中均涉及氧化还原反应
C.次氯酸和臭氧都是强氧化剂,都能杀死水中的细菌.自来水常用氯气来杀菌消毒,是因为氯气杀菌消毒效果要比臭氧好,且不会残留有毒、有害的物质
D.夏天到了,游客常佩戴添加了溴化银(或氯化银)和微量氧化铜的玻璃制作的变色眼镜来保护眼睛难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.向Fe(NO3)2稀溶液中加入醋酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
B.用铁作电极电解饱和食盐水:
C.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓
D.向明矾溶液中逐滴加入氢氧化钡溶液至沉淀质量最大:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.在标准状况下,11.2LNO与11.2LO2混合后所含分子数目为0.75NA
B.含有共价键数为NA的金刚石晶体的质量为3g
C.28g乙烯、丙烯、丙炔的混合气体中碳原子数大于2NA
D.在0.1mol蓝矾晶体和1L0.1moL•L-1AlCl3溶液中,金属阳离子总数均小于0.1NA难度: 中等查看答案及解析
-
如图,a、b、c均为石墨电极,d为碳钢电极,通电进行电解.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
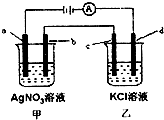
A.甲、乙两烧杯中溶液的pH均升高
B.当b极增重5.4g时,d极产生的气体为2.24L(标准状况)
C.当电解一段时间后,将甲、乙两溶液混合,一定会生成沉淀
D.乙烧杯中c的电极反应式为2Cl--2e-=Cl2↑难度: 中等查看答案及解析
-
下列有关实验操作的说法不正确的是
①用25ml碱式滴定管量取20.00mL KMnO4溶液
②用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低
③油脂皂化后可用盐析的方法使高级脂肪酸钠和甘油分离
④将固体加入容量瓶中的溶解并稀释至刻度,配制成一定物质的量浓度的溶液
⑤除去乙酸乙酯中少量的乙酸,用饱和碳酸钠溶液洗涤、分液、干燥、蒸馏
⑥测定中和热时,每组实验需测定温度3次
⑦向盛有少量苯酚浓溶液的试管里,滴入过量稀溴水有白色沉淀产生( )
A.①②④⑦
B.②④⑥⑦
C.①②③④
D.③⑤⑥⑦难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.0.1mol/LNaOH溶液和0.1mol/LNH4Cl溶液等体积混合后c(Na+)=c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)+c(CO32-)
C.只含有Na+、H+、Cl-、OH-的溶液中一定有:c(Cl-)=c(Na+)>c(H+)=c(OH-)
D.25℃时,PH=5,溶液为0.1mol•L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H-)难度: 中等查看答案及解析
-
下列叙述正确的是:
①热稳定性:H2O>HF>H2S②熔点:Al>Na>K,
③IA、IIA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④结合质子(H+)能力:CO32->HCO3->SO42-
⑤同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高
⑥已知2H2(g)+O2(g)=2H2O(1);△H=-571.6kJ•mol-1,则氢气的燃烧热为285.8kJ•mol-1,
⑦因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N( )
A.②③④
B.①⑥⑦
C.②④⑥
D.③⑤⑦难度: 中等查看答案及解析
-
如图:Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器.其它条件相同时,在Ⅰ、Ⅱ中分别加入3mol Z,起始时容器体积均为VL,发生如下反应并达到平衡:aX(?)+2Y(?)⇌3Z(g).此时II中X、Y、Z的物质的量之比为3:2:2,则下列说法一定正确的是( )
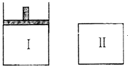
A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
B.若X、Y不均为气态,则平衡时X的产率:Ⅰ>Ⅱ
C.若X、Y均为气态,则从起始到平衡所需时间:Ⅰ>Ⅱ
D.若X为固态,Y为气态,到达平衡后若在Ⅱ中再加入1molZ,则新平衡时Z的体积分数不变难度: 中等查看答案及解析