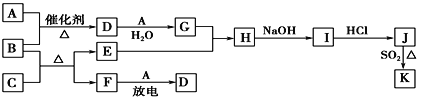
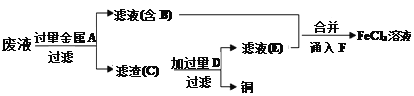
-
关于合金的说法不正确的是
A. 青铜是我国使用最早的合金 B. 钢是用量最大、用途最广的合金
C. 古代常用金属铁铸造货币 D. 焊锡中加入铅是为了降低熔点
难度: 简单查看答案及解析
-
做化学实验必须注意实验安全。下列做法正确的是
A. 金属钠保存在四氯化碳中 B. 制氯气在通风橱中进行
C. 金属钠着火用小苏打干粉灭火 D. 发生火灾拨打110报警电话
难度: 简单查看答案及解析
-
学习化学能培养科学、严谨的习惯,有助于提高我们的幸福指数。实验桌上部分药品的摆放如图所示。某同学取用KOH溶液以后应把它放回
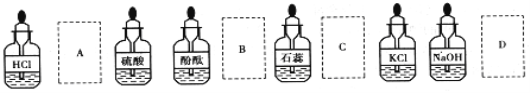
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
利用海水制取淡水的传统方法是
A. 蒸发 B. 过滤 C. 分液 D. 蒸馏
难度: 简单查看答案及解析
-
下列有关物质用途的叙述不正确的是
A. 单质硅可以做光导纤维
B. 明矾可用作净水剂
C. 氧化铝可用来制耐火坩埚
D. 二氧化硫可在某些行业用于杀菌消毒
难度: 简单查看答案及解析
-
下列有关物质分类或归类正确的是
A. 液氯、水玻璃均为混合物 B. 液氨、干冰均为化合物
C. 醋酸、P2O5均为电解质 D. Na2O2、Na2SiO3均为钠盐
难度: 简单查看答案及解析
-
设NA代表阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,22.4L氦气所含质子数为4NA
B. 3mol Fe在氧气中充分燃烧失去的电子数为9NA
C. 0.1mol Cl2全部溶于水后转移的电子数为0.1NA
D. 0.3mol NO2溶于水生成HNO3,转移的电子数目为0.2NA
难度: 简单查看答案及解析
-
下列铁的化合物通过化合反应、置换反应、复分解反应均能得到的是
A. Fe3O4 B. Fe2(SO4)3
C. FeCl2 D. Fe(OH)3
难度: 简单查看答案及解析
-
下列说法正确的是
A. 标准状况下,1mol H2O的体积约为22.4L
B. 11g CO2和5.6L N2所含分子数相同
C. 常温常压下,22.4L H2的物质的量小于1mol
D. 决定气体摩尔体积的主要因素是分子的大小
难度: 简单查看答案及解析
-
在下列各溶液中,离子一定能大量共存的是
A. 强碱性溶液中:K+、AlO2-、Cl-、SO42-
B. 强酸性溶液中:K+、SO42-、Fe2+、NO3-
C. 与铝反应产生大量氢气的溶液中:Na+、CO32-、NO3-、K+
D. 某无色溶液中:Fe3+、Cl-、Na+、NO3-
难度: 中等查看答案及解析
-
为除去括号内的杂质,所选用的试剂或方法不正确的是
A. Na2CO3固体(NaHCO3):加热
B. FeCl2溶液(FeCl3):加入足量铜粉,过滤
C. Na2O2粉末(Na2O):将混合物在氧气中加热
D. NaHCO3溶液(Na2CO3):通入过量的CO2气体
难度: 简单查看答案及解析
-
下列因果关系的判断正确的是
A. 因为反应时铝原子失去的电子比钠原子多,所以铝原子的还原性比钠原子强
B. 因为NaOH能中和H+,所以可以治疗胃酸过多
C. 因为氯水具有漂白性,所以可以使酸性KMnO4溶液褪色
D. 因为SO2溶于水生成亚硫酸,所以可以使石蕊变红
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A. AlCl3溶液与过量的氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
B. 硫酸亚铁溶液中滴加酸化的双氧水:2Fe2++2H++H2O2=2Fe3++2H2O
C. 二氧化硅与烧碱溶液反应:SiO2+OH-=SiO32-+H2O
D. 碳酸氢钙溶液中加入足量烧碱溶液:HCO3-+OH-=CO32-+H2O
难度: 简单查看答案及解析
-
下列关于元素化合物性质的叙述正确的是
A. Fe在少量Cl2中燃烧生成FeCl3
B. Al2O3和Fe2O3均可与NaOH溶液反应
C. SiO2与酸、碱均不发生反应
D. 二氧化硫、氯水均有漂白作用,其原理相同
难度: 简单查看答案及解析
-
向下列各溶液中通入足量CO2气体,最终有浑浊现象产生的是
①饱和Na2CO3溶液 ②澄清石灰水 ③NaAlO2溶液
④CaCl2溶液 ⑤Na2SiO3溶液
A. 全部 B. 除①④⑤外
C. 除①②④外 D. 除②④外
难度: 简单查看答案及解析
-
28g铁粉溶于稀盐酸中,然后加入足量的Na2O2固体,充分反应后过滤,将滤渣加强热,最终得到的固体质量为
A. 36g B. 40g C. 80g D. 160g
难度: 简单查看答案及解析
-
甲、乙、丙、丁分别是Al2(SO4)3、FeSO4、NaOH、BaCl2四种物质中的一种。若将甲溶液滴入乙溶液中,无明显现象发生,甲溶液滴入丙溶液时,发现有白色沉淀生成,继续滴加则沉淀消失。据此可推断丁物质是
A. Al2(SO4)3 B. FeSO4
C. NaOH D. BaCl2
难度: 中等查看答案及解析
-
下列检验或鉴别方法正确的是
A. 用澄清的石灰水鉴别Na2CO3和NaHCO3这两种溶液
B. 向溶液中滴加硝酸酸化的Ba(NO3)2溶液检验SO42-
C. 先加稀硝酸酸化,再滴入AgNO3溶液检验溶液中的Cl-
D. 加入氢氧化钠溶液,将湿润的红色石蕊试纸放在试管口不变蓝,证明无NH4+
难度: 中等查看答案及解析
-
FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、NO和H2O,当NO2与NO的物质的量之比为6:1时,实际参加反应的FeS与HNO3的物质的量之比为
A. 1:8 B. 1:7
C. 2:11 D. 1:6
难度: 中等查看答案及解析
-
将镁铝合金溶于100mL稀硝酸中,产生1.12L NO气体(标准状况),向反应后的溶液中加入NaOH溶液,产生沉淀情况如图所示。下列说法不正确的是
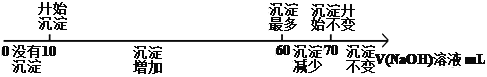
A. 可以求出合金中镁的质量 B. 氢氧化钠溶液浓度为3mol/L
C. 可以求出沉淀的最大质量 D. 不能求出硝酸的物质的量浓度
难度: 中等查看答案及解析