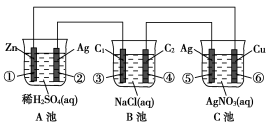
-
对H2O的电离平衡不产生影响的粒子是( )
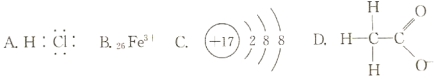
难度: 中等查看答案及解析
-
关于原电池的叙述正确的是( )
A.构成原电池的正极和负极必须是两种不同金属
B.原电池是把化学能转变为电能的装置
C.在铅、银和盐酸构成的原电池工作时,铅板上有5.18 g铅溶解,正极上就有1 120 mL(标准状况)气体析出
D.原电池工作时,正极和负极上发生的都是氧化还原反应
难度: 简单查看答案及解析
-
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:
Cd(OH)2+2Ni(OH)2
Cd+2NiO(OH)+2H2O 由此可知,该电池放电时的负极材料是 ( )
A.Cd(OH)2 B.Ni(OH)2 C.Cd D.NiO(OH)
难度: 中等查看答案及解析
-
某原电池总反应离子方程式为2Fe3++Fe===3Fe2+,能实现该反应的原电池是( )
A.正极为Cu,负极为Fe,电解质溶液为Fe(NO3)2溶液
B.正极为Cu,负极为Fe,电解质溶液为FeCl3溶液
C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液
D.正极为Ag,负极为Fe,电解质溶液为CuSO4溶液
难度: 简单查看答案及解析
-
pH=a的某电解质溶液中,插入两只惰性电极,通直流电一段时间后,溶液的pH>a,则该电解质可能是 ( )
A.H2SO4 B.AgNO3 C.Na2SO4 D.NaOH
难度: 中等查看答案及解析
-
如下图所示,各容器中盛有海水,铁在其中被腐蚀时,由快到慢的顺序是( )
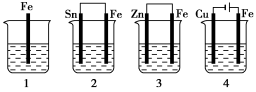
A.4>2>1>3 B.2>1>3>4
C.4>2>3>1 D.3>2>4>1
难度: 中等查看答案及解析
-
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )

A.两烧杯中铜片表面均无气泡产生 B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大 D.产生气泡的速度甲比乙慢
难度: 简单查看答案及解析
-
已知:4NH3(g)+5O2(g) == 4NO(g)+6H2O(g) △H=-1 025kJ/mol,该反应是一个可逆反应。若反应物 起始物质的量相同,下列关于该反应的示意图不正确的是( )

难度: 困难查看答案及解析
-
若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是( )
A.生成了一种强酸弱碱盐 B.弱酸溶液和强碱溶液反应
C.强酸溶液和弱碱溶液反应 D.一元强酸溶液和一元强碱溶液反应
难度: 中等查看答案及解析
-
在密闭容器中进行如下反应:X2(g)+Y2(g)
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
A. Z为0.3mol/L B. Y2为0.4mol/L C. X2为0.2mol/L D.Z为0.4mol/L
难度: 中等查看答案及解析
-
如图是关于反应A2(g)+3B2(g)
2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是( )

A.升高温度,同时加压 B.降低温度,同时减压
C.增大反应物浓度,同时减小生成物浓度 D.增大反应物浓度,同时使用催化剂
难度: 中等查看答案及解析
-
钢铁发生吸氧腐蚀时,正极上发生的电极反应是 ( )
A.2H++2e-=H2 ↑ B. Fe2++2e-=Fe
C. 2H2O+O2+4e-=4OH- D. Fe3++e-=Fe2+
难度: 简单查看答案及解析
-
已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“—”。关于标有“+”的接线柱,下列说法中正确的是 ( )
A.充电时作阳极,放电时作负极 B.充电时作阳极,放电时作正极
C.充电时作阴极,放电时作负极 D.充电时作阴极,放电时作正极
难度: 简单查看答案及解析
-
下列关于实验现象的描述不正确的是 ( )
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
难度: 简单查看答案及解析
-
常温下,0.1 mol/L某一元酸(HA)溶液中
=1×10-8,下列叙述正确的是( )
A.溶液中水电离出的c(H+)=10-10 mol/L
B.溶液中c(H+)+c(A-)=0.1 mol/L
C.溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
D.与0.05mol/L NaOH溶液等体积混合后所得溶液中离子浓度大小关系为c(A-)>c(Na+)>c(OH-)>c(H+)
难度: 困难查看答案及解析
-
把分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为 ( )
A.1︰2︰3 B.3︰2︰1 C.6︰3︰1 D.6︰3︰2
难度: 中等查看答案及解析
-
下列描述中,不符合生产实际的是 ( )
A.电解熔融的氧化铝制取金属铝,用铁作阳极 B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 D.在镀件上电镀锌,用锌作阳极
难度: 简单查看答案及解析
-
某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为:Li+LiMn2O4=Li2Mn2O4。下列说法正确的是 ( )
A.放电时,LiMn2O4发生氧化反应
B.放电时,正极反应为:Li++LiMn2O4+e-==Li2Mn2O4
C.充电时,LiMn2O4发生氧化反应
D.充电时,阳极反应为:Li++e-==Li
难度: 中等查看答案及解析
-
有一合金由X、Y、Z、W四种金属组成,若将合金放入盐酸中只有Z、Y能溶解;若将合金置于潮湿空气中,表面只出现Z的化合物;若将该合金做阳极,用X盐溶液作电解液,通电时四种金属都以离子形式进入溶液中,但在阴极上只析出X。这四种金属的活动性顺序是 ( )
A.Y>Z>W>X B.Z>Y>W>X C.W>Z>Y>X D.X>Y>Z>W
难度: 简单查看答案及解析
-
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.电解饱和食盐水时,阳极的电极反应式为:2Cl- +2e-=Cl2 ↑
B.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e- == 4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu -2e- == Cu2+
D.钢铁发生电化学腐蚀的负极反应式:Fe-2e- == Fe2+
难度: 简单查看答案及解析
-
电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和碳酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法正确的是( )
A.当电池负极消耗mg气体时,电解池阳极同时有mg气体生成
B.电池负极反应式为:O2 + 2H2O + 4e— = 4OH—
C.电解后c(Na2CO3)不变,且溶液中有晶体析出
D.电池中c(KOH)不变;电解池中溶液pH变大
难度: 困难查看答案及解析
-
报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:
2CH3OH + 3O2 + 4OH—
2CO32— + 6H2O,则下列说法错误的是 ( )
A.放电时CH3OH参与反应的电极为正极
B.充电时电解质溶液的pH逐渐增大
C.放电时负极的电极反应为:CH3OH-6e-+8OH- = CO32— + 6H2O
D.充电时每生成1 mol CH3OH转移6 mol电子
难度: 中等查看答案及解析
-
图
为直流电源,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为电镀槽.接通电路后发现
上的c点显红色.为实现铁上镀锌,接通
后,使c、d两点短路.下列叙述正确的是 ( )

A.a为直流电源的负极 B.d极发生的反应为2H++2e-=H2↑
C.f电极为锌板 D.e极发生氧化反应
难度: 中等查看答案及解析
-
某混合溶液中只含有两种溶质NaCl和H2SO4,且n(NaCl)︰n(H2SO4)=3︰1。若以石墨电极电解该溶液,下列推断中不正确的是 ( )
A.阴极产物为H2 B.阳极先析出Cl2,后析出O2
C.电解液的pH不断增大,最终大于7 D.整个电解的过程实质是电解水
难度: 中等查看答案及解析
-
通以相等的电量,分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比n硝酸银︰n硝酸亚汞=2︰1,则下列表述正确的是 ( )
A.在两个阴极上得到的银和汞的物质的量之比n银︰n汞=2︰1
B.在两个阳极上得到的产物的物质的量不相等
C.硝酸亚汞的化学式为HgNO3
D. 硝酸亚汞的化学式为Hg2(NO3)2
难度: 中等查看答案及解析