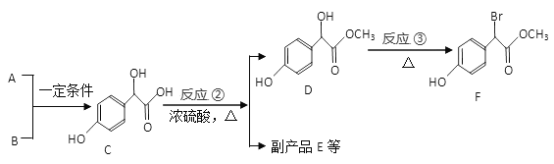
-
下列与化学有关的文献,理解错误的是
A. 《咏石灰》(明·于谦)中“…烈火焚烧若等闲…要留清白在人间”其中“清白”是指氢氧化钙
B. 《咏煤炭》(明·于谦)中“凿开混沌得乌金…不辞辛苦出山林”其中“乌金”的主要成分是煤炭
C. 《天工开物》中记载:“以消石、硫磺为主。草木灰为辅。…魂散惊而魄齑粉”文中提到的是火药
D. 《天工开物》中有如下描述:“世间丝、麻、裘、褐皆具素质…”文中的“裘”主要成分是蛋白质
难度: 简单查看答案及解析
-
化学材料在生活中应用广泛。下列材料制成的物品难降解的是
A. 木材造的纸张 B. 淀粉做的地膜
C. 蚕丝织的锦缎 D. 聚氯乙烯制的电话卡
难度: 简单查看答案及解析
-
化学与生产生活联系紧密,下列有关说法正确的是
A. 热的纯碱溶液可用于洗涤煤油、柴油等矿物油污
B. 水垢中的CaSO4,可先转化为CaCO3 ,再用酸除去
C. 胃舒平( 主要成分(AlOH)3]和食醋同时服用可增强药效
D. 淀粉和纤维素在体内最终水解为葡萄糖,为人体提供能量
难度: 中等查看答案及解析
-
下列实验操作能达到实验目的的是
A. 用CaCl2作干燥剂,可除去氨气中的水蒸气
B. 分液漏斗不能将水与乙醇分离,但可以分离苯和四氯化碳
C. 酸碱中和滴定时,滴定管和锥形瓶在使用前均需用待装液润洗
D. 测定同温同浓度的NaCl和CH3COONa的pH可比较HC1和CH3COOH的酸性强弱
难度: 中等查看答案及解析
-
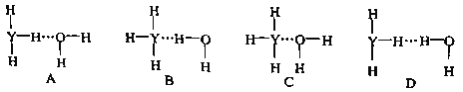
下列有关化学用语正确的是
A. 二氧化碳的电子式

B. 次氯酸的结构式为H—Cl—O
C. 用于考古断代的中子数为8的碳原子为
C
D. 2,4,6—三硝基甲苯的结构简式为

难度: 中等查看答案及解析
-
有三种有机物的分子式均为C8H8,其键线式分别表示为X:
,Y:
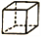 ,Z:
,Z:。下列说法正确的是
A. X、Z分子中所有原子一定在同一平面内
B. X、Y、Z都能发生取代反应、加成反应和氧化反应
C. X、Y、Z互为同分异构体,它们二氯代物的同分异构体数目不相同
D. X、Y、Z都能使酸性高锰酸钾溶液褪色,也能使溴的四氯化碳溶液褪色
难度: 中等查看答案及解析
-
如图为氟利昂(如CFCl3)破坏臭氧层的反应过程示意图,下列说法不正确的是
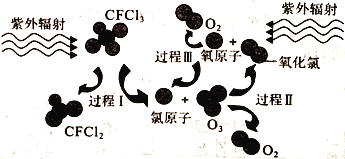
A. 过程Ⅰ中断裂极性键C—Cl键 B. 过程Ⅱ可表示为O3+Cl=ClO+O2
C. 过程Ⅲ中O+O=O2是吸热过程 D. 上述过程说明氟利昂中氯原子是破坏O3的催化剂
难度: 简单查看答案及解析
-
用下列实验装置进行相应实验,能达到实验目的的是(夹持装置未画出)
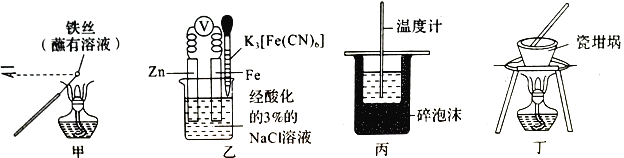
A. 用装罝甲检验溶液中是否有K+ B. 用装置乙验证牺牲阳极的阴极保护法
C. 用装置丙进行中和热的测定 D. 用装罝丁加热熔融NaOH固体
难度: 中等查看答案及解析
-
含氟的卤素互化物通常作氟化剂,使金属氧化物转化为氟化物,如2Co3O4+6C1F3= 6CoF3+3C12+4X。下列有关该反应的说法,正确的是
A. X与O3互为同位素 B. ClF3中氯元素为-3价
C. Co3O4在反应中作氧化剂 D. lmol Co3O4参加反应转移9 mol电子
难度: 困难查看答案及解析
-
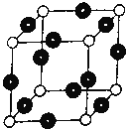
N4分子结构为正四面体(如图所示)。已知:断裂N4(g)中1 molN-N键吸收193kJ能量,形成N2(g)中1 mol N≡N放出941 kJ能量。下列说法正确的是

A. N4(g)比N2(g)更稳定
B. N4(g)=2N2(g) △H=+724kJ•mol-1
C. 形成1 mol N4(g)中的化学键放出193 kJ的能量
D. lmolN2(g)完全转化为N4(g),体系的能量增加362kJ
难度: 中等查看答案及解析
-
部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,下列说法正确的是
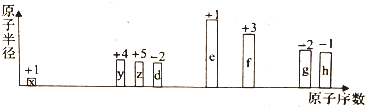
A. 离子半径的大小顺序:d<e<f
B. 与x形成简单化合物的沸点:y>z>d
C. 除去实验后试管中残留的g单质,可用热的氢氧化钠溶液
D. g、h的氧化物对应的水化物的酸性:h>g
难度: 中等查看答案及解析
-
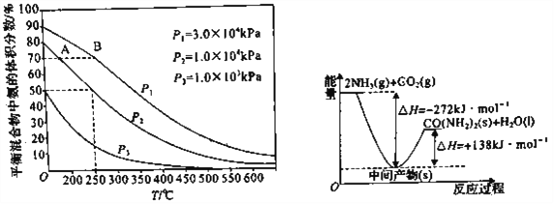
对于可逆反应 SiO2(s)+C(s)+N2(g)
Si3N4(s)+CO(g)(未配平)△H <0,下列叙述正确的是
A. 该反应的氧化剂为N2,还原产物为CO
B. 增加焦炭的用量,生成氮化硅的反应速率增大
C. 反应中每生成0.1 mol Si3N4转移的电子为1.2 mol
D. 反应的平衡常数可表示为K=c(CO)/c(N2),升高温度K减小
难度: 中等查看答案及解析
-
向体积均为10mL且物质的量浓度相同的两份NaOH溶液中分别通入一定量的CO2得到溶液甲和乙。向甲、乙两溶液中分别滴加0.1 mol·L-1盐酸,此时反应生成CO2体积(标准状况)与所加盐酸体积间的关系如图所示。则下列叙述中正确的是

A. 原NaOH溶液的物质的量浓度为0.5 mol·L-1
B. 当0<V(HCl)<10mL时,甲溶液中发生反应的离子方程式为OH-+H+=H2O
C. 乙溶液中含有的溶质是Na2CO3、NaHCO3
D. 乙溶液中滴加盐酸后产生CO2体积的最大值为224mL(标准状况)
难度: 困难查看答案及解析
-
常温下,pH=l 的某溶液 A 中除H+外,还含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、 Cl-、I-、SO42-中的4种,且溶液中各离子的物质的量浓度均为0.1mol·L-1。现取该溶液进行有关实验,实验结果如下图所示,下列有关说法正确的是

A. 该溶液中一定有上述离子中的NO3-、Al3+、SO42-、Cl-四种离子
B. 实物消耗Cu14.4g,则生成气体丁的体积为3.36L
C. 该溶液一定没有Fe3+,但是无法确定是否含有I-
D. 沉淀乙一定有BaCO3,可能有BaSO4
难度: 困难查看答案及解析