-
下列各组物质中,一定都属于纯净物的是
A.液氯和氯水 B.酒精溶液和乙醇
C.饱和食盐水和硫酸亚铁 D.干冰和混有冰的水
难度: 简单查看答案及解析
-
小美在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连环物质间不能发生反应。你认为“五连环”中物质间发生的反应,没有涉及的基本反应类型是
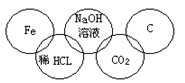
A、复分解反应 B、分解反应
C、化合反应 D、置换反应
难度: 简单查看答案及解析
-
在标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3,下列对这四种气体的关系从大到小表达正确的是
a.体积②>③>①>④ b.密度②>③>④>①
c.质量②>③>①>④ d.氢原子个数①>③>④>②
A.abc B.bcd C.abcd D.acd
难度: 简单查看答案及解析
-
17.1%的蔗糖溶液200g,加适量的水稀释到5L,求稀释后的蔗糖溶液的物质的量浓度(蔗糖相对分子质量为342)
A. 0.2 mol·L-1 B.0.3 mol·L-1 C.0.02 mol·L-1 D.0.1 mol·L-1
难度: 简单查看答案及解析
-
我国稀土资源丰富。下列有关稀土元素144 62Sm与150 62Sm的说法正确的是
A.144 62Sm与150 62Sm互为同位素 B.144 62Sm与150 62Sm的质量数相同
C.144 62Sm与150 62Sm是同一种核素 D.144 62Sm与150 62Sm的中子数相同
难度: 简单查看答案及解析
-
氯化铁溶液与氢氧化铁胶体的共同点是
A.分散质颗粒直径都在l~100nm之间 B.都能透过半透膜
C.都是分散系 D.颜色都呈红褐色
难度: 简单查看答案及解析
-
下列物质的保存方法错误的是
A. 少量金属钠保存在煤油中
B. 氢氧化钠保存在塑料瓶中
C. 块状碳酸钙固体保存在细口玻璃瓶中
D. 稀盐酸可保存在细口磨砂玻璃瓶中
难度: 简单查看答案及解析
-
将一定量CO2通入下列溶液中,可能变浑浊的是
①CaCl2稀溶液 ②澄清石灰水 ③饱和Na2CO3溶液 ④稀H2SO4
A. ①② B.②③ C.③④ D. ①②③
难度: 简单查看答案及解析
-
在一定温度下,向饱和的烧碱溶液中放入一定量的过氧化钠,充分反应后恢复到原来温度,下列说法正确的是
A.溶液中氢氧化钠的浓度增大,有氧气放出
B.溶液中氢氧化钠的浓度减小,有氧气放出
C.溶液中氢氧化钠的质量减小,有氧气放出
D.溶液中氢氧化钠的质量增大,有氧气放出
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A.石灰石溶于盐酸:CO32- + 2H+ == H2O +CO2↑
B.Al2O3粉末溶于NaOH溶液中:Al2O3+2OH-=2AlO2-+H2O
C.硫酸氢钠溶液与氢氧化钡溶液的反应:Ba2++SO42-=BaSO4↓
D.氧化钠加入盐酸中:O2-+2H+===H2O
难度: 简单查看答案及解析
-
下列离子在溶液中能大量共存的是
A.Fe3+、NH4+、SCN-、Cl- B.强碱性溶液:Na+、HCO3-、SO42-
C.Fe2+、Fe3+、 Na+、NO3- D.Fe2+、NH4+、Cl- 、OH-
难度: 简单查看答案及解析
-
在120℃的条件下,总质量为2.1 g的CO与H2的混合气体在足量的O2中充分燃烧,然后通过足量的Na2O2固体,固体增加的质量为
A. 7.2 g B. 4.2 g C.3.6 g D. 2.1 g
难度: 简单查看答案及解析
-
在常温下,发生下列几种反应 2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2↑ +8H2O
‚Cl2 + 2NaBr = 2NaCl + Br2 ƒBr2 + 2FeBr2 = 2FeBr3
根据上述反应,下列结论正确的是
A.还原性强弱顺序为:Br—>Fe2+>Cl—
B. 氧化性强弱顺序为:MnO4—>Cl2>Br2>Fe3+
C. 反应中,当生成1molCl2 时,被氧化的HCl为3.2mol
D. 溶液中可发生反应:2Fe3+ + 2Cl— = 2Fe2+ + Cl2↑
难度: 简单查看答案及解析
-
在下列物质的溶液中,加入CaCl2溶液不产生沉淀,再加入NaOH溶液才产生沉淀的是
A.Na2CO3 B.AgNO3 C.NaHCO3 D.KOH
难度: 简单查看答案及解析
-
某溶液中只含有Na+, Al3+, Cl-,SO42-四种离子,已知Na+, Al3+, Cl-的个数比为3:2:1。则溶液中Al3+与SO42-离子的个数比为
A.1:2 B.1:4 C.3:4 D.3:2
难度: 简单查看答案及解析
-
在CuO和Fe粉的混合物中,加入一定量的稀硫酸,并微热,当反应停止后,滤出不溶物,并向滤液中插入一枚铁钉,发现铁钉并无任何变化。根据上述现象,确定下面结论正确的是
A. 不溶物一定是Cu B. 不溶物一定含铜,但不一定含铁
C. 不溶物一定是Fe D. 溶液中一定含有Fe2+,但不一定含有Cu2+
难度: 简单查看答案及解析
-
下列物质中既能与稀H2SO4反应, 又能与NaOH溶液反应的是
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤Na2CO3
A.③④ B.①②③④
C.①③④ D.全部
难度: 简单查看答案及解析
-
铅的冶炼大致过程如下:
①富集:将方铅矿(PbS)进行浮选;②焙烧:2PbS+3O2
2PbO+2SO2;
③制粗铅:PbO+C
Pb+CO;PbO+CO
Pb+CO2。
下列说法正确的是
A.浮选法富集方铅矿的过程属于化学变化
B.方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO
C.整个冶炼过程中,制取1molPb共转移2mol电子
D.将1molPbS冶炼成Pb理论上至少需要6g碳
难度: 简单查看答案及解析
-
某K2CO3固体样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或二种。现将13.8g样品加入足量水,样品全部溶解,再加入过量的CaCl2溶液,得到9g沉淀。对样品所含杂质判断完全正确的是
A.肯定有KNO3 B.肯定有KNO3,可能还含有Na2CO3
C.肯定没有Ba(NO3)2,可能有KNO3 D.肯定没有Na2CO3和Ba(NO3)2
难度: 简单查看答案及解析
-
向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。 随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如右图所示。则下列说法中正确的是
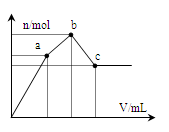
A.a点对应的沉淀只有BaSO4
B.c点溶液呈碱性
C.b点发生反应的离子方程式是:
Al3++2SO42-+2Ba2++3OH— == Al(OH)3↓+2BaSO4↓
D.c点加入Ba(OH)2溶液的体积为200 mL
难度: 简单查看答案及解析



