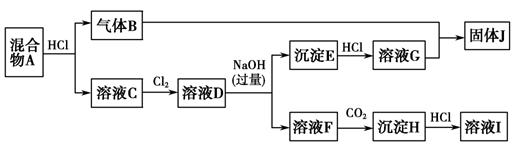
-
常温下,把2.7g铝投入到一定量氢氧化钠溶液中,充分反应后,下列表示正确的是(NA为阿佛加德罗常数)
电子转移
反应的Al
溶液中的AlO2-
生成的H2
A
0.2NA
0.1NA
B
0.3NA
0.3NA
C
2.7g
3.36L
D
0.1NA
2.7g
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数的值,下列叙述正确的是
A.在0.2 mol·L-1的Na2CO3溶液中含有Na+的数目为0.4NA
B.0.1 mol Fe参加氧化还原反应,转移的电子数目一定是0.3 NA
C.15.6 g Na2O2 与过量CO2反应时,转移的电子数为0.4NA
D.标准状况下22.4 L CH4和C2H4的混合气体所含氢原子数为4NA
难度: 简单查看答案及解析
-
化学概念在逻辑上存在下图所示关系:对下列概念的说法正确的是
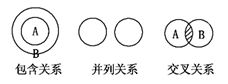
A.纯净物与混合物属于包含关系
B.化合物与氧化物属于包含关系
C.单质与化合物属于交叉关系
D.氧化还原反应与化合反应属于并列关系
难度: 简单查看答案及解析
-
能大量共存于同一溶液中,且当溶液中加入过量的NaOH溶液或少量稀硫酸时,都能产生白色沉淀的离子组是
A.Ba2+、Mg2+、NO、CO B.H+、Ba2+、Al3+、Cl-
C.K+、Ba2+、Cl-、HCO D.NH、Ba2+、Fe3+、Cl-
难度: 简单查看答案及解析
-
下列反应的离子方程式书写正确的是
A.用稀HNO3溶解FeS固体:FeS+2H+===Fe2++H2S↑
B.氯气通入澄清石灰水中:Cl2+2OH-===Cl-+ClO-+H2O
C.SO2气体通入NaClO溶液中:SO2+2ClO-+H2O===SO+2HClO
D.硅酸钠溶液中通入过量二氧化碳:SiO+CO2+H2O===H2SiO3↓+CO
难度: 简单查看答案及解析
-
常温下,在溶液中可以发生反应:X+2Y3+=2Y2++X2+,则下列叙述
①X被氧化;②X是氧化剂;③X具有还原性;④Y2+是氧化产物;
⑤Y2+具有还原性;⑥Y3+的氧化性比X2+的氧化性强。
以上叙述中正确的是
A.②④⑥ B.①③④ C.①③⑤⑥ D.②⑤
难度: 简单查看答案及解析
-
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是
①向饱和碳酸钠溶液中通入过量的CO2 ②向Fe(OH)3胶体中逐滴加入过量的稀硫酸 ③向AgNO3溶液中逐滴加入过量氨水 ④向硅酸钠溶液中逐滴加入过量的盐酸
A.①② B.①③ C.①④ D.②③
难度: 简单查看答案及解析
-
2012年4月15日,央视《每周质量报告》报道某著名制药企业使用工业明胶制造有毒胶囊,其中铬元素含量超标。铬是人体必需的微量元素,它与脂类代谢有密切联系,能增强人体内胆固醇的分解和排泄,但铬过量会引起污染,危害人类健康。不同价态的铬毒性不同,三价铬对人体几乎无毒,六价铬的毒性为三价铬的100倍。下列叙述错误的是
A.污水中的Cr3+在溶解的氧气的作用下可被氧化为Cr2O72—
B.K2Cr2O7可以氧化乙醇,该反应可用于检查酒后驾驶
C.在反应Cr2O72—+I一+H+→Cr3++I2 +H2O中,氧化产物与还原产物的物质的量之比为3:2
D.发生铬中毒时,可服用维生素C缓解毒性,因为维生素C具有还原性
难度: 简单查看答案及解析
-
由CO2、H2和CO组成的混合气在同温同压下与氮气的密度相同, 则该混合气体中CO2 H2和CO的体积比为
A.29:8:13 B.22:1:14 C.13:8:29 D.26:15:57
难度: 简单查看答案及解析
-
将1.12 g铁粉加入25 mL 2 mol·L-1氯化铁溶液中,充分反应后,其结果是
A.铁有剩余,溶液呈浅绿色,Cl-浓度基本不变
B.往溶液中滴入无色KSCN溶液,显红色
C.Fe2+和Fe3+的物质的量之比为5∶1
D.氧化产物与还原产物的物质的量之比为2∶5
难度: 简单查看答案及解析
-
下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是
A.取a g混合物充分加热,减重b g
B.取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体
C.取a g混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b g
D.取a g混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b g固体
难度: 简单查看答案及解析
-
下列各组在溶液中的反应,不管反应物的量是多少,都能用同一离子方程式表示的是
A.FeBr2与Cl2 B.Ba(OH)2与H2SO4
C.HCl与Na2CO3 D.NaHCO3与Ca(OH)2
难度: 简单查看答案及解析
-
下列说法不正确的是
A.区别溶液和胶体的方法是当一束光线通过胶体时可出现一条光亮的通路,溶液则没有此现象
B.将饱和FeCl3溶液滴入沸水中,继续加热煮沸至红褐色停止加热即得Fe(OH)3胶体
C.胶体带电荷,溶液不带电荷
D.土壤胶粒的比表面积巨大且一般带负电,能吸附NH等营养离子,使土壤具有保肥能力
难度: 简单查看答案及解析
-
将40 mL 1.5 mol·L-1的CuSO4溶液与30 mL 3 mol·L-1的NaOH溶液混合生成浅蓝色沉淀,假如溶液中Cu2+或OH-浓度都已变得很小,可忽略,则生成沉淀的组成可表示为
A.Cu(OH)2 B.CuSO4·Cu(OH)2
C.CuSO4·2Cu(OH)2 D.CuSO4·3Cu(OH)2
难度: 简单查看答案及解析
-
某合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a,将其全部投入50 mL b mol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是
A.若金属有剩余,在溶液中再滴入硫酸后,金属不溶解
B.若金属全部溶解,则溶液中一定含有Fe3+
C.若金属全部溶解,且产生336 mL气体(标准状况),则b = 0.3
D.当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-a/3)
难度: 简单查看答案及解析
-
将35g锌粉与少量浓硫酸在加热条件下充分反应,共收集到混合气体11.2L(标准状况),其质量为19.6g,则过剩的锌粉的质量为
A.1.0g B.2.0g C.2.5g D.3.5g
难度: 简单查看答案及解析
-
下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是
编号
化学反应
离子方程式
评价
①
硫酸溶液中加入Ba(OH)2溶液
Ba2++SO=BaSO4↓
正确
②
氧化铝与NaOH溶液反应
2Al3++3O2-+2OH-=
2AlO+H2O
错误,Al2O3不应写成离子形式
③
铁和稀硝酸反应
Fe+2H+===H2↑+Fe2+
正确
④
等物质的量的FeBr2和Cl2反应
2Fe2++2Br-+2Cl2=2Fe3++Br2+
4Cl-
错误,离子方程式中Fe2+与Br-的物质的量之比与化学式不符
A.只有② B.①③ C.②④ D.①②③④
难度: 简单查看答案及解析
-
实验室将9 g铝粉跟一定量的金属氧化物粉末混合形成铝热剂。发生铝热反应之后,所得固体中含金属单质为18 g,则该氧化物粉末不可能是
A.Fe2O3和MnO2 B.Fe2O3和V2O5 了 C.Cr2O3和V2O5 D.Fe3O4和FeO
难度: 简单查看答案及解析
-
下列叙述正确的是
A.Li在氧气中燃烧主要生成Li2O2
B.将SO2通入BaCl2溶液可生成BaSO3沉淀
C.将CO2通入次氯酸钙溶液可生成次氯酸
D.将NH3通入热的CuSO4溶液中能使Cu2+还原成Cu
难度: 简单查看答案及解析
-
向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。向反应后的溶液中加入c mol·L-1氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是
A.c= B.p=m+ C.n=m+17Vc D.m<p<m
难度: 简单查看答案及解析