-
在世界海运史上曾发生过这样一个悲剧:一艘名叫“阿那吉纳”号的货轮满载着精选铜矿砂,在向日本海岸行驶时突然发生大面积漏水,最终沉没。坚硬的钢制船体为什么会突然漏水呢?事后的事故调查结果表明导致沉船的原因与船上的精选铜矿砂密切相关。下列对此调查结论的理解正确的是( )
A. 精铜矿砂装载过多导致沉船
B. 运输途中铜与空气中的氧气发生氧化反应导致质量增大,超过船的承载能力
C. 在潮湿的环境中,船体与铜构成了原电池,加速了作为负极的船体的腐蚀
D. 在潮湿的环境中,船体与铜构成了电解池,钢制船体作阳极而被氧化腐蚀
难度: 中等查看答案及解析
-
某溶液中含有Cu2+、Fe2+、Al3+、Cl-、NO
,且浓度均为0.1 mol/L,用石墨作电极进行电解时,肯定得不到的产物是( )
A. Cl2 B. Al
C. Cu D. H2
难度: 中等查看答案及解析
-
下列关于电化学知识的说法正确的是( )
A. 电解饱和食盐水在阳极得到氯气,阴极得到金属钠
B. 电解精炼铜时,阳极质量的减少不一定等于阴极质量的增加
C. 电解AlCl3、FeCl3、CuCl2的混合溶液,在阴极上依次析出Al、Fe、Cu
D. 电解CuSO4溶液一段时间后(Cu2+未反应完),加入适量Cu(OH)2可以使溶液恢复至原状态
难度: 中等查看答案及解析
-
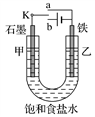
如图所示的电化学装置,下列叙述不正确的是( )
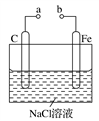
A. a和b用导线连接,电子由铁经过导线流向碳
B. a和b用导线连接,铁电极的电极反应式为:Fe-2e-===Fe2+
C. a、b分别连接直流电源正、负极,可以防止铁被腐蚀
D. a、b分别连接直流电源负、正极,电压足够大时,Na+向铁电极移动
难度: 中等查看答案及解析
-
常温下用惰性电极电解NaHSO4溶液,电解一段时间后,下列有关电解质溶液变化的说法正确的是( )
A. 电解质溶液的浓度增大,pH减小
B. 电解质溶液的浓度增大,pH增大
C. 电解质溶液的浓度减小,pH减小
D. 电解质溶液的浓度不变,pH不变
难度: 中等查看答案及解析
-
用如图装置电解K2SO4溶液,同时制备H2SO4溶液和KOH溶液,Ⅱ中装入K2SO4溶液,下列有关分析正确的是( )
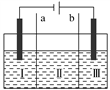
A. Ⅰ区生成H2SO4
B. a是阴离子交换膜
C. Ⅱ区的K+进入Ⅰ区
D. Ⅲ区溶液的pH会升高
难度: 中等查看答案及解析
-
某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是( )
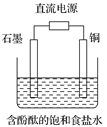
A. 铜电极附近观察到黄绿色气体
B. 石墨电极附近溶液呈红色
C. 溶液中的Na+向石墨电极移动
D. 铜电
极上发生还原反应
难度: 中等查看答案及解析
-
结合图示判断,下列叙述正确的是( )
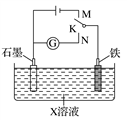
A. K与N连接时,X为硫酸,一段时间后溶液的pH增大
B. K与N连接时,X为氯化钠,石墨极电极反应式为2H++2e-===H2↑
C. K与M连接时,X为硫酸,一段时间后溶液的pH增大
D. K与M连接时,X为氯化钠,石墨极电极反应式为4OH--4e-===2H2O+O2↑
难度: 困难查看答案及解析
-
在铜片上镀银时,下列叙述正确的是( )
①将铜片接在电源的正极上 ②将银片接在电源的正极上 ③在铜片上发生的反应是:Ag++e-===Ag ④在银片上发生的反应是:4OH--4e-===O2↑+2H2O ⑤需用硫酸铜溶液为电镀液 ⑥需用硝酸银溶液为电镀液
A. ①③⑥ B. ②③⑥
C. ①④⑤ D. ②③④⑥
难度: 中等查看答案及解析
-
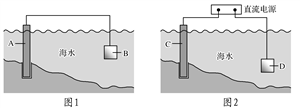
下面两套实验装置,都涉及金属的腐蚀反应,假设其中的金属块和金属丝都是足量的。下列叙述正确的是( )
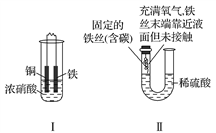
A. 装置Ⅰ在反应过程中只生成NO2气体
B. 装置Ⅱ开始阶段铁丝只发生析氢腐蚀
C. 装置Ⅱ在反应过程中能产生氢气
D. 装置Ⅰ在反应结束时溶液中的金属阳离子只有Cu2+
难度: 困难查看答案及解析
-
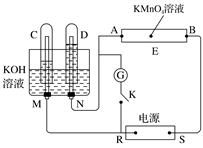
用电解法可提纯含有某种含氧酸根杂质的粗KOH溶液,其工作原理如图所示。下列有关说法错误的是( )
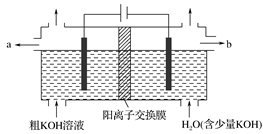
A. 阳极反应式为4OH--4e-===2H2O+O2↑
B. 通电后阴极区附近溶液的pH会增大
C. K+通过交换膜从阴极区移向阳极区
D. 纯净的KOH溶液从b口导出
难度: 困难查看答案及解析
-
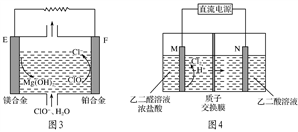
常温下,NCl3是一种黄色黏稠状液体,是制备新型水消毒剂ClO2的原料,可以采用如图所示装置制备NCl3。下列说法正确的是( )
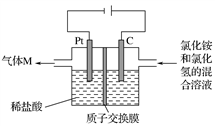
A. 每生成1 mol NCl3,理论上有4 mol H+经质子交换膜向右侧向左侧迁移
B. 可用湿润的淀粉-KI试纸检验气体M
C. 石墨极的电极反应式为NH
+3Cl--6e-===NCl3+4H+
D. 电解过程中,质子交换膜右侧溶液的pH会减小
难度: 困难查看答案及解析