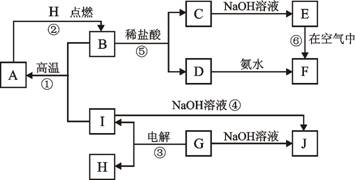
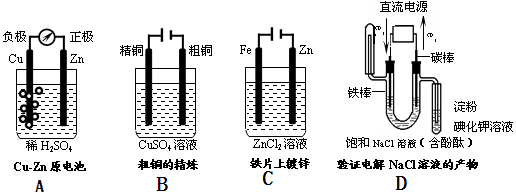
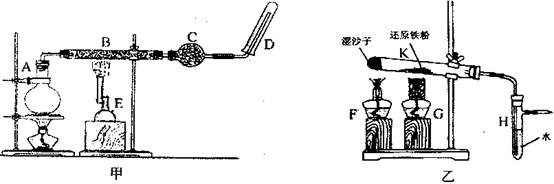
-
下列转化不属于煤或石油的综合利用的是
A.将煤干馏制得煤焦油和焦炭 B. 在一定条件下将煤与氢气转化为液体燃料
C. 将煤变为煤饼作燃料 D.将石油裂解制得乙烯等化工原料
难度: 中等查看答案及解析
-
碘131I可用于治疗晚期原发性肝癌,目前已投入临床使用。下列关于碘131I说法正确的是
A.131I是一种新元素 B.131I的摩尔质量为131g
C.该种原子构成的碘单质分子的相对分子质量约为262
D.这里所涉及到的碘,指的是碘元素的一种新单质
难度: 中等查看答案及解析
-
下列各图所示装置的气密性检查中,一定漏气的是
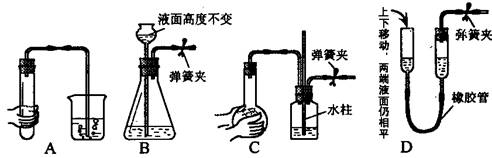
难度: 中等查看答案及解析
-
反应4A(g )+3B(g) ==2C(g)+D(g),经2min,B的浓度减少0.6 mol•L-1。对此反应速率的表示,正确的是
①用A表示的反应速率是0.4 mol•L-1•min-1
②分别用B、C、D表示的反应速率其比值为3:2:1
③在2 min末的反应速率,用B表示是0.3 mol•L-1•min-1
④在这2 min内用B表示的反应速率的值是逐渐减小的,用C表示的反应速率的值是逐渐增大的
A. ①② B. ③ C. ① D. ②④
难度: 中等查看答案及解析
-
下列各组离子在相应的条件下一定能大量共存的是
A.pH= 1溶液中:NO3-、K+、Cl-、Fe2+
B.某无色溶液中:MnO4-、Mg2+、Na+ 、SO42-
C.pH试纸变深红色的溶液中:NH4+、Ca2+ 、Cl-、K+
D.水电离出的c(H+)=1×10-13mol/L的溶液中:NH4+、SO42-、NO3-、K+
难度: 中等查看答案及解析
-
下列叙述不正确的是
A.“雨后彩虹”“海市蜃楼”既是一种自然现象又是光学现象,也与胶体的性质有关
B.我国规定自2008年6月1日起,商家不得无偿提供塑料袋,目的是减少“白色污染”
C.严格的讲,“通风橱”是一种不负责任的防污染手段,因为实验生成的有害气体没有得到转化或吸收
D.长期盛放NaOH溶液的滴瓶不易打开,是因为NaOH与瓶中的CO2反应使瓶内气体减少形成“负压”之故
难度: 中等查看答案及解析
-
汽车排放的尾气中因含有氮的氧化物而污染大气。产生氮的氧化物的主要原因是
A.燃烧含氮的化合物燃料引起的 B.燃烧含铅汽油引起的
C.是由燃烧不充分引起的 D.是在汽缸中N2被氧化生成的
难度: 中等查看答案及解析
-
下列稀溶液置于空气中,一段时间后,pH变小的是(不考虑溶质的挥发)
①H2SO4 ②Ca(OH)2 ③氯水 ④Na2SO3 ⑤H2S
A.①②③④ B.①③④ C.①③⑤ D.②④⑤
难度: 中等查看答案及解析
-
某溶液中存在的离子有:S2-、HS-、OH-、Na+、H+,则下列有关对该溶液的叙述中不正确的是
A.离子浓度可能是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
B.组成该溶液的溶质只能是Na2S或NaHS或两者的混合物
C.该溶液可能呈中性,或碱性,或酸性
D.离子物质的量的关系是2n(S2-)+n(HS-)+n(OH-)=n(Na+)+n(H+)
难度: 中等查看答案及解析
-
下列物质的分类结果全部正确的是
A.焦炉气—混合物 胆矾—纯净物 臭氧—单质
B.纯碱—碱 硫化氢—酸 小苏打—酸式盐
C.硫酸—离子化合物 氨气—共价化合物
D.液氯—非电解质 硫酸钡—强电解质 醋酸—弱电解质
难度: 中等查看答案及解析
-
半导体工业用石英砂做原料,通过三个重要反应生产单质硅:
①SiO2(s)+2C(s) = Si(s)+2CO(g) △H = +682.44 kJ/mol
(石英砂) (粗硅)
②Si(s)+2Cl2(g) = SiCl4(g) △H = -657.01kJ/mol
(粗硅)
③SiCl4(g)+2Mg(s) = 2MgCl2(s)+Si(s) △H = -625.63 kJ/mol
(纯硅)
生产1.00kg纯硅的总反应热为
A.+2.43×104kJ B.-2.35×104kJ C.-2.23×104kJ D.-2.14×104kJ
难度: 中等查看答案及解析
-
下列浓度关系正确的是
A.氯水中:c(Cl2) = 2[c(ClO-)+c(Cl-)+c(HClO)]
B.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
C.等体积等浓度的氢氧化钠与醋酸混合: c(Na+) = c(CH3COO-)
D.Na2CO3溶液中:c(Na+)>c(CO32 -)>c(OH-)>c(HCO3- )>c(H+)
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.1mol·L-1NaCl溶液含有NA个Na+
B.电解精炼铜时转移了6.02×1023个电子,阳极溶解32 g铜
C.任意条件下,16g O3所含的原子数为NA
D.标准状况下,22.4 L SO3所含的分子数为NA
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A.铜片插入氯化铁溶液中: Cu+Fe3+=Cu2++Fe2+
B.漂白粉溶液中通入过量的二氧化碳:Ca2++2ClO-+CO2+H2O====CaCO3↓+2HClO
C.用小苏打治疗胃酸过多:HCO3- + H+ = H2O + CO2↑
D.NaOH和Ba(OH)2混合溶液中通入少量CO2 : 2OH-+ CO2=CO32-+H2O
难度: 中等查看答案及解析
-
某溶液中含有HCO、SO、CO、CH3COO- 4种阴离子.若向其中加入足量的Na2O2后,溶液中离子浓度基本保持不变的是
A.CH3COO- B.SO C.CO D.HCO
难度: 中等查看答案及解析
-
水的三态的熵值的大小关系正确的是
A. Sm(s) >Sm(l) >Sm(g) B. Sm(l) >Sm(s) >Sm(g)
C. Sm(g) >Sm(l) >Sm(s) D. Sm(g) >Sm(s) >Sm(l)
难度: 中等查看答案及解析
-
在复杂体系中,确认化学反应先后顺序有利于解决问题。下列反应先后顺序判断正确的是
A.在含等物质的量的HCO3−、OH−、CO32−的溶液中,逐滴加入盐酸:OH−、HCO3−、CO32−
B.在含等物质的量的Al3+、H+、NH4+的溶液中,逐滴加入NaOH溶液:NH4+H+、Al3+、Al(OH)3
C.在含等物质的量的I−、Br− 、SO32− 的溶液中,缓慢通入Cl2: Br− 、I−、SO32−
D.在含等物质的量的Fe3+、Cu2+、H+的溶液中,加入Zn:Fe3+、Cu2+、H+、Fe2+
难度: 中等查看答案及解析
-
下图曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,下列叙述正确的是

A.盐酸的物质的量浓度为1 mol/L
B.P点时反应恰好完全,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠的滴定曲线
D.酚酞不能用作本实验的指示剂
难度: 中等查看答案及解析
-
铜板上铁铆钉处的吸氧腐蚀原理如下图所示,下列有关说法中,不正确的是
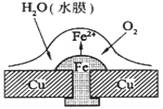
A.正极电极反应式为:2H++2e- → H2↑
B.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.此过程中铜并不被腐蚀
D.此过程中电子从Fe移向Cu
难度: 中等查看答案及解析