-
佛山陶瓷在中国陶瓷行业中拥有举足轻重的地位。陶瓷属于硅酸盐材料,是以含硅物质经过加热制成。下列含硅元素的物质中属于盐的是
A.Si B.SiO2 C.H2SiO3 D.Na2SiO3
难度: 中等查看答案及解析
-
近年来,人类生产、生活所产生的污染,如机动车、燃煤、工业等排放的尾气,使灰霾天气逐渐增多。灰霾粒子比较小,平均直径大约在1000~2000nm左右。下列有关说法正确的是
A.灰霾是一种分散系
B.灰霾能发生丁达尔现象
C.灰霾形成的是非常稳定的体系
D.戴口罩不能阻止呼入灰霾粒子
难度: 简单查看答案及解析
-
佛山西樵山是岭南名山,有“天然氧吧”之美誉。山林里空气中的自由电子附着在O2分子上形成负氧离子(O2—),被称为“空气维生素”。O2—的摩尔质量为
A.32
B.16
C.32g•mo1—1
D.16 g•mo1—1
难度: 简单查看答案及解析
-
家里的食用玉米油不小心混入了大量的水。要将玉米油与水分离,最简便的方法是
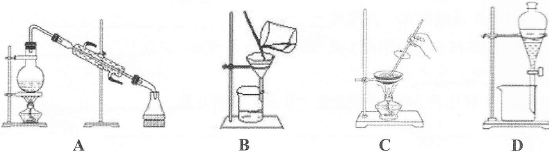
难度: 简单查看答案及解析
-
12月2日1时30分,“嫦娥三号”奔月探测器发射成功。“嫦娥三号”装有电解水制氢气装置,以提供气象探测系统所需要的高纯度氢气。围绕反应方程式2H2O
2H2↑+O2↑,下列有关判断正确的是
A.氧化剂是氢元素
B.还原产物是O2
C.H2O既有氧化性也有还原性
D.2molH2O反应,转移了8mol电子
难度: 中等查看答案及解析
-
以NA代表阿伏加德罗常数,下列说法正确的是
A.32g O2所含的原子数目为2NA
B.11.2L H2O含有的原子数目为1.5NA
C.1mol的Cl—含NA个电子
D.0.5mol/L的NaCl溶液中Cl—的个数为是0.5NA
难度: 中等查看答案及解析
-
下列有关叙述正确的是
A.溶于水后能电离出H+的化合物都是酸
B.BaSO4不溶于水,故BaSO4不是电解质
C.CO2溶于水能导电,故CO2是电解质
D.尽管NaCl固体不导电,但NaCl是电解质
难度: 中等查看答案及解析
-
下列各组实验过程中,现象不是先出现沉淀后沉淀又溶解的是
A.在澄清石灰水中不断地通入CO2
B.在FeSO4溶液中不断地滴加NaOH溶液
C.在AlCl3溶液中不断地滴加NaOH溶液
D.在Fe(OH)3胶体中不断地滴加稀H2SO4溶液
难度: 中等查看答案及解析
-
下列属于右边关系图中阴影部分的化学反应是

A.2Na+O2
Na2O2
B.2Na2O2+2CO2=2Na2CO3+O2
C.2KMnO4
K2MnO4+MnO2+O2↑
D.Fe+H2SO4=FeSO4+H2↑
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.碳酸氢钠与稀盐酸反应:HCO3—+H+=CO2↑+H2O
B.铝溶于NaOH溶液:Al+2OH—=AlO2—+H2↑
C.碳酸镁中滴加稀盐酸:CO32—+2H+=CO2↑+H2O
D.硫酸铜溶液中滴加氢氧化钡溶液:Cu2++2OH—=Cu(OH)2↓
难度: 中等查看答案及解析
-
下列有关离子的检验方法和判断正确的是
A.向某溶液中加入Na2CO3溶液,若有白色沉淀生成,证明一定含有Ca2+
B.向某固体中加入稀盐酸,产生了无色气体,证明该固体一定含有CO32—
C.向某溶液中滴加KSCN溶液,若溶液出现红色则说明原溶液中含Fe3+
D.向某溶液中先加稀硝酸,再加BaC12溶液,生成白色沉淀,证明一定含有SO42—
难度: 中等查看答案及解析
-
在FeCl3和CuSO4溶液中加入过量的铁粉,经过滤后测定反应前后溶液的质量不变(不计过滤损失)。则原来溶液中FeCl3和CuSO4的物质的量之比为
A.1∶1 B.2∶1 C.1∶7 D.2∶7
难度: 中等查看答案及解析
-
某同学用物质的量之比为1∶1的NaNO3和KCl的混合物进行实验:在10℃时,将混合物逐渐加入到烧杯中的水中,一边加一边搅拌。根据下表四种盐在10℃时的溶解度进行判断,上述实验过程中最先析出的晶体是
NaNO3
KNO3
NaCl
KCl
溶解度(g)
80.5
20.9
35.7
31.0
A.NaNO3 B.KNO3 C.NaCl D.KC1
难度: 中等查看答案及解析
-
化学与社会生活联系非常的紧密,下列有关分析错误的是
A.铝很活泼但在生活中应用广泛,是因为铝表面有一层致密的保护膜
B.过氧化钠能应用在飞船中作供氧剂,是因为过氧化钠受热分解得到氧气
C.节日燃放烟花呈现五彩缤纷的颜色,是因为发生了焰色反应
D.铝盐和铁盐可用作净水剂,是因为A13+和Fe3+能直接与水中杂质反应
难度: 中等查看答案及解析
-
在酸性溶液中,下列各组离子能大量共存且溶液为无色透明的是
A.Na+、K+、OH—、Cl—
B.Na+、Fe2+、SO42—、NO3—
C.Mg2+、Na+、SO42—、 Clˉ
D.K+、Na+、NO3—、CO32—
难度: 中等查看答案及解析
-
实验室有三缸废液,分别含有Na2CO3、Ca(OH)2和HCl,且它们的物质的量之比为1∶1∶2。要让三缸废液混合后,所得溶液的溶质只有NaCl,应选择的混合顺序是(注:过滤等实验操作己省略)
A.先将Na2CO3废液和Ca(OH)2废液混合,再与HCl废液混合
B.先将Na2CO3废液和HCl废液混合,再与Ca(OH)2废液混合
C.先将Ca(OH)2废液和HCl废液混合,再与Na2CO3废液混合
D.将Na2CO3废液和Ca(OH)2废液同时慢慢倒入HCl废液中
难度: 中等查看答案及解析