-
下列说法不正确的是
A.化学反应有新物质生成,并遵循质量守恒定律和能量守恒定律
B.原子吸收光谱仪可用于测定物质中的金属元素,红外光谱仪可用于测定化合物的官能团
C.分子间作用力比化学键弱得多,但它对物质熔点、沸点有较大影响,而对溶解度无影响
D.酶催化反应具有高效、专一、条件温和等特点,化学模拟生物酶对绿色化学、环境保护及节能减排具有重要意义
难度: 简单查看答案及解析
-
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是 ( )
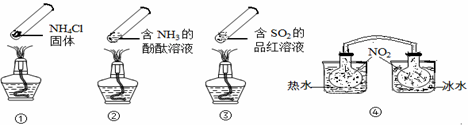
A.加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好
B.加热时,②、③溶液均变红,冷却后又都变为无色
C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅
D.四个“封管实验”中所发生的化学反应都是可逆反应
难度: 简单查看答案及解析
-
若把元素所处的族分为主族、副族、Ⅷ族和0族四类,下列数字分别为元素原子的次外层和最外层上的电子数,其中可以肯定为副族元素的是 ( )
A.18,1 B.8,2 C.18,3 D.18,8
难度: 简单查看答案及解析
-
下列说法不正确的是
A.变色硅胶干燥剂含有CoCl2,干燥剂呈蓝色时,表示不具有吸水干燥功能
B.硝基苯制备实验中,将温度计插入水浴,但水银球不能与烧杯底部和烧杯壁接触
C.中和滴定实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用
D.除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶
难度: 简单查看答案及解析
-
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g/L;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A.原子半径:W>Z>Y>X>M
B.XZ2、X2M2、W2Z2均为直线型的共价化合物
C.由X元素形成的单质不一定是原子晶体
D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键
难度: 简单查看答案及解析
-
下列各组离子能在指定环境中大量共存的是
A.在C(HCO3-)=0.1mol/L的溶液中NH4+、Al3+、Cl-、NO3-
B.在由水电离出的C(H+)=1×10-12mol/L的溶液中AlO2-、HCO3-、Na+、SO42-
C.在使红色石蕊试纸变蓝的溶液中SO32-、CO32-、Na+、K+
D.PH=1的溶液中Mg2+、Fe2+、NO3-、[Ag(NH3)2]+
难度: 简单查看答案及解析
-
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是
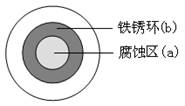
A.液滴中的Cl―由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-
4OH-
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为Cu-2e-=Cu2+
难度: 简单查看答案及解析
-
下图所示对实验选用或实验操作正确的是 ( )
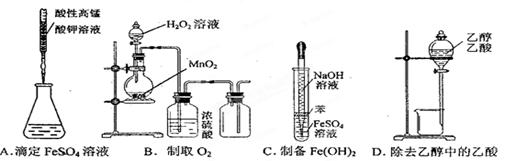
难度: 中等查看答案及解析
-
下列各组物质间反应可能包括多步反应,其总的离子方程式正确的是
A.等体积、等物质的量浓度的明矾溶液和Ba(OH)2溶液混合:3Ba2++6OH -+2Al3++3SO42- ="==" 2Al(OH)3↓+3BaSO4↓
B.FeCl2在空气中被氧化:4Fe2+ + O2 + 2H2O = 4Fe3+ + 4OH -
C.AlCl3 (aq)中投入过量Na:2Al 3+ + 6Na + 6H2O = 2Al(OH)3 ↓ + 6Na+ + 3H2↑
D.FeBr2 (aq) 中通入少量Cl2:2Fe2+ + 4Br- + 3Cl2 = 2Fe3+ + 2 Br2 + 6Cl-
难度: 困难查看答案及解析
-
2.0molPCl3和1.0molCl2充入体积不变的密闭容器中,在一定条件下发生反应PCl3(g)+Cl2(g)
PCl5(g),达平衡时PCl5为0.4mol,如果此时移走1.0molPCl3和0.5molCl2,在 相同温度下再次达到平衡时,PCl5的物质的量为 ( )
A.0.4mol
B.0.2mol
C.小于0.2mol
D.大于0.2mol,小于0.4mol
难度: 困难查看答案及解析
-
.在密闭容器中,对于反应N2+3H2
2NH3,在反应起始时N2和H2分别为1mol和3mol, 当达到平衡时,N2的转化率为30%,若以NH3为起始反应物,反应条件与上述反应相同,则NH3的起始的物质的量和它的转化率为
A.4mol 35% B.2mol 30% C.2mol 70% D.1mol 15%
难度: 中等查看答案及解析
-
在100mL某混合溶液中,c(HNO3)="0.4" mo/lL、c(H2SO4)="0.1" mol/L,向其中加入1.92gCu粉,微热充分反应后溶液中的c(Cu2+)为
A.0.15mol/L B.0.225mo1/L C.0.3mo1/L D.无法计算
难度: 困难查看答案及解析
-
将SO2和X气体分别通入BaCl2溶液,未见沉淀生成,若同时通入,有沉淀生成,则X气体不可能是
A.CO2 B.NH3 C.C12 D.H2S
难度: 困难查看答案及解析
-
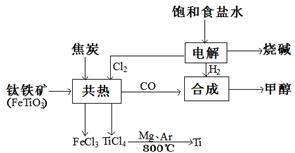
海水是重要的资源,可以制备一系列物质(见图4)。
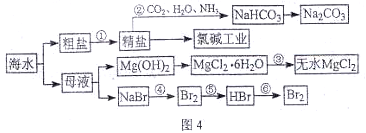
下列说法正确的是( )
A.步骤②中,应先通CO2,再通NH3
B.步骤③可将MgCl2·6H2O晶体在空气中直接加热脱水
C.步骤④、⑤、⑥反应中,溴元素均被氧化
D.除去粗盐中的SO42—、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤→盐酸
难度: 中等查看答案及解析
-
CS2是一种恶臭气体,把它滴入用硫酸酸化的KMnO4溶液中,有一种淡黄色沉淀析出,同时把产生的CO2通入A mol Ca(OH)2的溶液中得到B mol白色沉淀,则CS2被氧化时,转移电子的物质的量为
A.白色沉淀物质的量的1/3 B.4Bmol或4(2A-B)mol
C.氧化产物的4倍 D.Ca(OH)2的物质的量的4倍或3倍
难度: 困难查看答案及解析
-
在溶液中,反应
C分别在三种不同实验条件下进行,它们的起始状态均为
、
、
。在三种条件下,反应物A的浓度随时间的变化如图所示。下列说法中正确的是( )
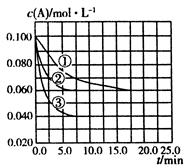
A.反应的平衡常数:①<②
B.反应A+2B
C的
C.实验②平衡时B的转化率为60%
D.实验③平衡时
难度: 困难查看答案及解析
-
将17.9g由Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生气体3.36L(标准状况)。另取等质量的合金溶于过量的稀硝酸中,向反应后的溶液中加入过量的NaOH溶液,得到沉淀的质量为25.4g。若HNO3的还原产物仅为NO,则生成NO的标准状况下的体积为( )
A.2.24L B.4.48L C.6.72L D.8.96L
难度: 困难查看答案及解析
-
相同状况下,在容积相同的三个烧瓶内,分别充满干燥的NH3、HCl、NO2气体.然后分别做喷泉实验,实验结束后,烧瓶内3种溶液的物质的量浓度之比为 ( )
A.3:3:2: B.1:1:1: C.2:2:3: D.无法比较
难度: 简单查看答案及解析
-
a g下列物质在氧气中充分燃烧后的气体(1.01×105 Pa,120℃),通过足量的过氧化钠充分反应后,过氧化钠增重b g,符合b>a 的选项有
A.HCHO B.CH3COOCH2CH3 C.HOOCCOOH D.蔗糖
难度: 简单查看答案及解析
-
在短周期中的X和Y两种元素可组成化合物XY3,则下列说法中正确的是( )
A.若X的原子序数是m,则Y的原子序数必定是m
4
B.XY3晶体一定属于离子晶体
C.X与Y可属于两个不同周期,也可属于同一周期
D.X的原子半径小于Y的原子半径
难度: 简单查看答案及解析
-
将8.34 g FeSO4·7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)见右图。下列说法正确的是( )
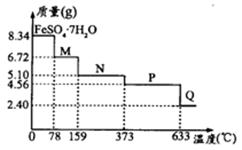
A.FeSO4·7H2O晶体中有4种不同结合力的水分子
B.在100℃时,M的化学式为FeSO4·6H2O
C.在200℃时,N的化学式为FeSO4·3H2O
D.380℃的P加热至650℃的化学方程式为:
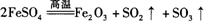
难度: 简单查看答案及解析
-
向含Al2(SO4)和AlCl3的混合溶液中逐滴加人1mol/L Ba(OH)2溶液至过量,加人Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( )
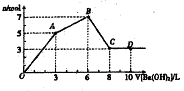
A.图中C点铝元素存在形式是
B.向D点溶液中通人C02气体,立即产生白色沉淀.
C原混合液中
D. OA段反应的离子方程式为
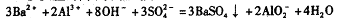
难度: 简单查看答案及解析