-
下列有关能量的判断或表示方法正确的是
A.从C(石墨)=C(金刚石) ΔH=1.9 kJ·mol-1,可知金刚石比石墨更稳定
B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多
C.由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则向含0.1 mol HCl的盐酸中加入4.0 gNaOH固体,放出热量等于5.73 kJ
D.2 gH2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为: 2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
难度: 中等查看答案及解析
-
H2S水溶液中存在电离平衡H2S
H++HS-和HS-
H++S2-。若向H2S溶液中
A.滴加新制氯水,溶液pH减小 B.通入过量SO2气体,溶液pH增大
C.加水,溶液中氢离子浓度增大 D.加入少量硫酸铜固体,所有离子浓度都减小
难度: 中等查看答案及解析
-
下列有关说法正确的是
A.NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的ΔH<0
B.镀锌铁制品镀层破损后,铁制品比受损前更容易生锈,而镀锡铁则相反
C.对于N2(g)+3H2(g)
2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应和逆反应速率以及H2的平衡转化率均增大
D.100℃时水的离子积常数Kw为5.5×10-13,说明水的电离是放热反应
难度: 中等查看答案及解析
-
Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是
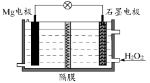
A.Mg电极是该电池的正极
B.石墨电极附近溶液的pH增大
C.H2O2在石墨电极上发生氧化反应
D.溶液中Cl-向正极移动
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是

A.图I表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图Ⅱ表示表示向KAl(SO4)2溶液中滴加Ba(OH)2溶液产生沉淀的物质的量(n)随氢Ba(OH)2溶液体积(V)的变化
C.图Ⅲ表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
D.图Ⅳ表示某可逆反应生成物的物质的量随反应时间变化的曲线,t时刻反应正速率最大
难度: 中等查看答案及解析
-
下列与含氯化合物有关的说法正确的是
A.HClO是弱酸,所以NaClO是弱电解质
B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
C.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物
D.电解NaCl溶液得到22.4 L H2(标准状况),理论上需要转移NA个电子
难度: 中等查看答案及解析
-
下列说法不正确的是
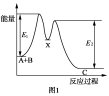
A.NH3·H2O
NH4++OH-达到平衡后,升高温度平衡正向移动
B.在海轮的外壳上镶入锌块,可减缓船体的腐蚀速率
C.明矾水解生成Al(OH)3胶体,可用作净水剂
D.如图所示的反应过程中A+B→X的△H<0,X→C的△H>0
难度: 中等查看答案及解析
-
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO: MgSO4(s)+ CO(g)
MgO(s)+CO2(g)+SO2(g) ΔH>0 该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
选项
X
Y
A
温度
容器内混合气体的密度
B
CO的物质的量
CO2与CO的物质的量之比
C
SO2的浓度
平衡常数K
D
MgSO4的质量(忽略体积)
CO的转化率
难度: 中等查看答案及解析
-
室温下,对于0.10 mol·L-1的氨水,下列判断正确的是
A.与AlCl3溶液发生反应的离子方程式为Al3++3OH-
Al(OH)3↓
B.其溶液的pH=13
C.用适量水稀释后,NH3·H2O电离度和溶液pH都增大
D.加水稀释后,溶液中c(NH4 +)·c(OH-)变小
难度: 中等查看答案及解析
-
一定温度下,在4个容积均为1 L的恒容容器中分别进行反应(各容器中A都足量)A(s)+B(g)
C(g)+D(g) ΔH =+100 kJ·mol-1,某时刻测得部分数据如下表:
容器编号
n(B)/mol
n(C)/mol
n(D)/mol
反应时间/min
反应速率
Ⅰ
0.06
0.60
0.10
t1
v(正)=v(逆)
Ⅱ
0.12
1.20
0.20
t2
Ⅲ
0.32
1.0
0
0
Ⅳ
0.12
0.30
v(正)=v(逆)
下列说法正确的是
A.容器Ⅰ中平均反应速率v(B)=0.04/t1 mol·L-1·min-1
B.t2时容器Ⅱ中v(正)>v(逆)
C.容器Ⅲ中反应至平衡时吸热20 kJ
D.容器Ⅳ中c(D)= 0.4 mol·L-1
难度: 中等查看答案及解析
-
0.1 mol·L-1某酸HA溶液的pH=2,则该溶液中有关浓度关系式正确的是
A.c(H+)>c(A-) B.c(H+)>c(HA) C.c(OH-)>c(HA) D.c(HA)>c(A-)
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.水电离出的c(H+)=10-12mol/L的溶液中:Ca2+、K+、Cl-、HCO3-
C.c(H+)/c(OH-)=1012的水溶液中:NH4+、Al3+、NO3-、Cl-
D.c(Fe3+)=0.1mol/L的溶液中:K+、ClO-、SO42-、SCN-
难度: 中等查看答案及解析
-
一定条件下存在反应:A(g)+B(g)
C(g)+D(g) ΔH<0。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 molA和1 mol B,在Ⅱ中充入1 mol C和1 mol D,在Ⅲ中充入2 mol A和2 mol B,500℃条件下开始反应。达到平衡时,下列说法正确的是
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ、Ⅲ中反应的平衡常数相同
C.容器Ⅰ中A的物质的量比容器Ⅱ中的多
D.容器Ⅰ中A的转化率与容器Ⅱ中C的转化率之和小于1
难度: 困难查看答案及解析
-
在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g)
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是

A.200℃时,反应从开始到平衡的平均速率v(B)= 0. 02 mol·L-1·min-1
B.图Ⅱ所知反应xA(g)+yB(g)
zC(g)的△H<0,且a=2
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于0.5
难度: 中等查看答案及解析
-
恒温恒容下,往一真空密闭容器中通入一定量的气体A,发生如下反应: 3A(g)
2B(g)+xC(g)。达平衡后,测得容器内的压强增大了p%,A的平衡转化率为a%,则下列推断中正确的是
A.若x=2,则p>0.5a B.若x=3,则p<0.7a
C.若x=4,则p= a D.若x= 5,则p≥a
难度: 中等查看答案及解析

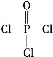 )与季戊四醇(
)与季戊四醇(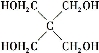 )以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢谱如下图所示。
)以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢谱如下图所示。
