-
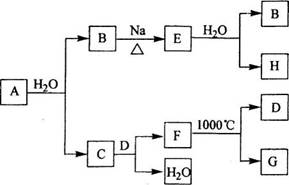
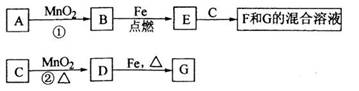 A~G各物质间的关系如下图,其中B、D为气态单质。
A~G各物质间的关系如下图,其中B、D为气态单质。
请回答下列问题:
(1)物质C和E的名称分别为________________.__________________;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为_____________;
若只能在加热情况下进行,则反应物A应为_____________;
(3)反应②的化学方程式为_______________________________________;
(4)新配制的F溶液应加入_____________以防止其转化为G。检验G溶液中阳离子的常用试剂是_____________,实验现象为____________________________。
-
高炉炼铁过程中发生的主要反应为

已知该反应在不同温度下的平衡常数如下:
请回答下列问题:
(1)该反应的平衡常数表达式K=_____________,△H________0(填“>”.“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe.Fe2O3.CO.CO2各1.0 mol,反应经过l0 min后达到平衡。求该时间范围内反应的平均反应速率υ(C02)= _____________.CO的平衡转化率= _____________:
(3)欲提高(2)中CO的平衡转化率,可采取的措施是_____________。
A.减少Fe的量 B.增加Fe203的量 C.移出部分C02
D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂
-


18-I(6分)已知: ,如果要合成 所用的原始原料可以是
A. 2-甲基-l,3-丁二烯和2-丁炔 B.1,3-戊二烯和2-丁炔
C.2,3-二甲基-1,3-戊二烯和乙炔 D.2,3-二甲基-l,3-丁二烯和丙炔
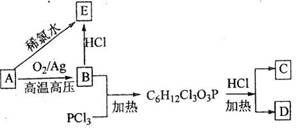
18-II(14分)A~G都是有机化合物,它们的转化关系如下:
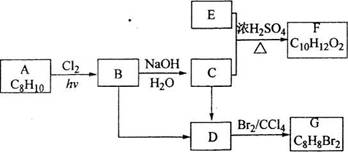
请回答下列问题:
(1)已知:6.0g化合物E完全燃烧生成8.8g C02和3.6g H20;E的蒸气与氢气的相对密度为30,则E的分子式为_______________:
(2)A为一取代芳烃,B中含有一个甲基。由B生成C的化学方程式为_______________;
(3)由B生成D.由C生成D的反应条件分别是_______________._______________;
(4)由A生成B.由D生成G的反应类型分别是_______________._______________;
(5)F存在于栀子香油中,其结构简式为_______________;
(6)在G的同分异构体中,苯环上一硝化的产物只有一种的共有___________个,其中核磁共振氢谱有两组峰,且峰面积比为l:1的是_______________ (填结构简式)。
-
19-I(6分)下列描述中正确的是
A.CS2为V形的极性分子
B.Cl0— 3 的空间构型为平面三角形
C.SF6中有6对完全相同的成键电子对
D.SiF4和SO2— 3 的中心原子均为sp3杂化
19-Ⅱ(14分)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为______________________________;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填“<”或“>”);
(3)NiO晶胞中Ni和O的配位数分别为_______________._______________;
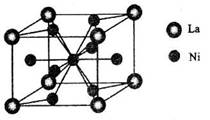
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为_______________;
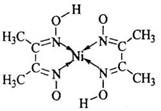
(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如右上图所示。
①该结构中,碳碳之间的共价键类型是 键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;
键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;
②该结构中,氧氢之间除共价键外还可存在_______________;
③该结构中,碳原子的杂化轨道类型有_______________。
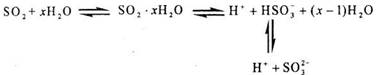
 A~G各物质间的关系如下图,其中B、D为气态单质。
A~G各物质间的关系如下图,其中B、D为气态单质。