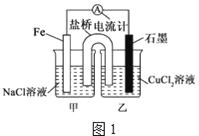
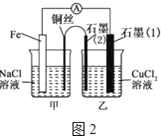
-
有4 种混合溶液,分别由等体积0.1mol/L 的2 种溶液混合而成:①CH3COONa 与HCl ;② CH3COONa 与NaOH;③CH3COONa与NaCl;④ CH3COONa 与NaHCO3
下列各项排序正确的是
A. pH:②>③>④>① B. c(CH3COO-):②>④>③>①
C. 溶液中c(H+):①>③>②>④ D. c(CH3COOH):① >④>③>②
难度: 中等查看答案及解析
-
下列物质的水溶液因水解而呈碱性的是( )
A. NH3·H2O B. NaHCO3 C. Ba(OH)2 D. NH4Cl
难度: 简单查看答案及解析
-
碱性锌锰干电池的总反应方程式可以表示为:Zn+2MnO2+2H2O==Zn(OH)2+2MnOOH 此电池放电时,正极上发生反应的物质是( )
A. 碳棒 B. MnO2和H2O C. Zn D. MnO2
难度: 简单查看答案及解析
-
常温下,下列溶液中各离子浓度关系表述正确的是( )
A. 向NH4HSO4溶液中逐滴加入NaOH溶液至中性,溶液中c(Na+) > c(SO42-) > c(NH4+) > c(H+) = c(OH-)
B. 等物质的量浓度的Na2CO3,NaHCO3混合溶液中c(Na+) > c(CO32-) >c(HCO3-) > c(OH-) > c(H+)
C. 已知酸性HF > CH3COOH,pH相等的NaF与CH3COOK溶液中c(Na+)-c(F-) < c(K+)-c(CH3COO-)
D. 在0.1mol/L 的Na2S溶液中 c(H+) + c(HS-) + c(H2S) = c(OH-)
难度: 困难查看答案及解析
-
不能证明一元酸HA为弱酸的是( )
A. 相同条件下HA溶液的导电性弱于盐酸 B. 0.1mol/L的HA溶液pH为3
C. HA溶液中滴加石蕊显红色 D. NaA溶液显碱性
难度: 中等查看答案及解析
-
室温时,饱和Mg(OH)2溶液的pH=11,则该温度下Mg(OH)2的溶度积为( )
A. 5×10-34 B. 1×10-9 C. 1×10-22 D. 5×10-10
难度: 中等查看答案及解析
-
如图是课外活动小组设计的用化学电源使LED灯发光装置。下列说法不正确的是( )
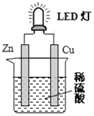
A. 锌是负极,电子从锌片经导线流向铜片
B. 铜片表面有气泡生成
C. 如果将硫酸换成橙汁,导线中不会有电子流动
D. 装置中存在“化学能→电能→光能”的转换
难度: 简单查看答案及解析
-
固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许O2-在其间通过。该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是( )
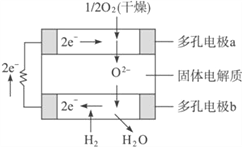
①多孔电极a为负极
②a极对应的电极反应式为O2+2H2O+4e-==4OH-
③b极的电极反应式为H2-2e-+O2-==H2O
④该电池的总反应式为2H2+O2
2H2O
A. ①② B. ②④ C. ②③ D. ③ ④
难度: 中等查看答案及解析
-
下列各步制取物质,最终无法达到目的的有( )
A. Al
Al2O3
AlCl3溶液
Al2O3
B. Cu
CuO
CuSO4溶液
CuSO4·5H2O
C. Fe
FeCl3
Fe(OH)3
Fe2O3
D. Al2(SO4)3溶液
Al(OH)3
难度: 中等查看答案及解析
-
有等体积、等pH的Ba(OH)2、KOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是( )
A. V3>V2>V1 B. V3=V2=V1 C. V3>V2=V1 D. V1=V2>V3
难度: 困难查看答案及解析
-
如图所示,将铁片和锌片放在盛有NaCl溶液(其中滴有酚酞)的表面皿中,最先观察到变为红色的区域为( )
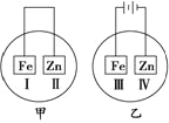
A. Ⅰ和Ⅱ B. Ⅱ和Ⅲ C. Ⅰ和Ⅳ D. Ⅱ和Ⅳ
难度: 中等查看答案及解析
-
已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性。现有浓度均为0.1mol/L的的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中正确的是( )
A. c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-) B. c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
C. c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-) D. 两溶液中的c(Na+)、c(HRO3-)和c(RO32-)分别相等
难度: 困难查看答案及解析
-
用惰性电极电解R(NO3)n的水溶液,当一个电极上增重m g时,在另一电极上产生V L(标准状况)气体,则R的相对原子质量为( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
室温下向10mL、0.1mol/L的NaOH溶液中加入0.1mol/L的HA溶液,溶液pH的变化曲线如图所示。下列说法正确的是( )
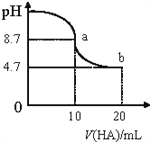
A. pH=7时,c(Na+)= c(A-)+c(HA)
B. a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
C. b点所示溶液中:c(A-)>c(HA)
D. a、b两点所示溶液中水的电离程度相同
难度: 困难查看答案及解析
-
下列叙述正确的是( )
A. 工业上电解熔融的Al2O3冶炼铝用铁做阳极
B. 用惰性电极电解饱和NaCl溶液,若有1mol电子转移,则生成1molNaOH
C. 用Pt做电极电解Na2SO4溶液,阴、阳两极产物的物质的量之比为1∶2
D. 用碳棒做电极电解CuSO4溶液一段时间后,加入Cu(OH)2固体可以使CuSO4溶液恢复原来浓度
难度: 中等查看答案及解析
-
某学习小组为研究电化学原理,设计右图装置。下列叙述正确的是( )
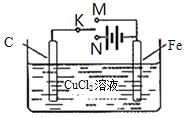
A. K与M相连时,每转移1mol电子Fe表面生成32gCu
B. K与N相连时,碳棒上产生使湿润的淀粉-KI试纸变蓝的气体
C. K分别与M、N相连时,铁均受到保护
D. K与M、N均断开,一段时间后电解质溶液质量变大
难度: 中等查看答案及解析
-
用石墨作电极电解100mLAgNO3溶液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原AgNO3溶液的物质的量浓度为( )
A. 3mol·L-1 B. 2mol·L-1 C. 1.5mol·L-1 D. 1mol·L-1
难度: 困难查看答案及解析
-
据报道,以NaBH4(B为+3价)和H2O2做原料的新型燃料电池可用作深水勘探等无空气环境下的电源,其结构如右图所示.该电池总反应式为:NaBH4+4H2O2=NaBO2+6H2O,下列的说法正确是( )
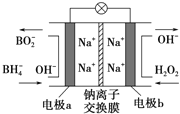
A. 放电过程中,Na+从右向左迁移
B. a为正极,其电极反应为:BH4--8e-+8OH-=BO2-+6H2O
C. b电极的电极反应式为:H2O2+2e-+2H+=2H2O
D. 每消耗300g、34%的H2O2溶液,理论上流过电路中的电子数为6NA个
难度: 困难查看答案及解析
-
常温下,用0.1mol/L的盐酸滴定0.1mol/L的Na2CO3溶液25mL。测得溶液pH变化曲线如图,下列说法正确的是( )
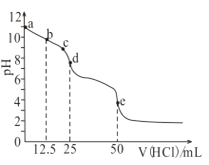
A. b点时,c(CO32-)>c(HCO3-)>c(OH-)
B. d点时,c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
C. e点时,c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
D. c→d发生的主要离子反应:H++HCO3-=CO2↑+H2O
难度: 困难查看答案及解析
-
25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol/L的一组CH3COOH、CH3COONa的混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述正确的是( )
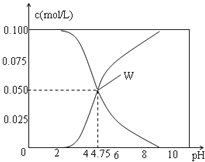
A. pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol/L
B. pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
C. W点所表示的溶液中:c(H+)=c(CH3COOH)+c(OH-)
D. 向W点所表示的1.0L溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-)
难度: 困难查看答案及解析