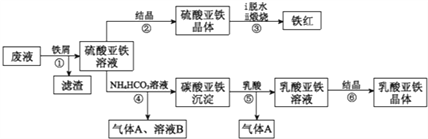
-
化学与生产,生活密切相关下列有关说法中不正确的是
A. 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱
B. PM2.5是指大气中直径接近2.5×10-6m的颗粒物,其分散在空气中形成胶体
C. “青蒿一握,以水二升渍,绞取汁”,该过程属于物理变化
D. “煤改气”,“煤改电”等清洁燃料改造工程有利于减少雾霾天气
难度: 中等查看答案及解析
-
对分别盛有不同无色溶液①②③④四支试管进行如下操作。现象和结论对应正确的是
操作
现象
结论
A
向①中滴加NaOH溶液,加热,将湿润红色石蕊试纸置于试管口
试纸变蓝
原溶液中有NH4+
B
向②中滴入NaHCO3溶液
有白色沉淀生成
原溶液中有AlO2-
C
向③中先滴加BaCl2溶液再滴加HCl溶液
生成白色沉淀
原溶液中有SO42-
D
向④中滴加氯水和CCl4,振荡静置
下层溶液呈橙色
原溶液中有I-
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
工业上合成乙苯的反应为
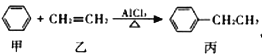 ,下列说法不正确的是
,下列说法不正确的是A. 乙、丙均可以使酸性高锰酸钾溶液褪色
B. 该反应属于加成反应
C. 甲、乙均可通过石油分馏获取
D. 丙的一氯代物有5种
难度: 中等查看答案及解析
-
四种短周期元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法不正确的是
A. 气态氢化物的稳定性Y<Z
B. W与X形成的化合物中只存在离子键
C. W的氢化物分子之间都能形成氢键
D. W、X、Y三种元素组成的化合物的水溶液不一定呈中性
难度: 困难查看答案及解析
-
新型锂-空气电池具有能量密度高的优点,可以用作新能源汽车的电源,其结构如图所示,其中固体电解质只允许Li+通过。下列说法正确的是
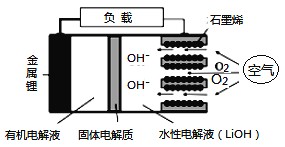
A. Li+穿过固体电解质向正极移动而得到LiOH溶液
B. 放电时,当外电路中有1 mol e-转移时,水性电解液离子总数增加NA
C. 应用该电池电镀铜,阴极质量增加64 g,理论上将消耗11.2 L O2
D. 放电时,负极反应式:Li-e-+OH-=LiOH
难度: 中等查看答案及解析
-
一定条件下,在水溶液中1 mol Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是
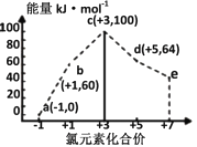
A. a、b、c、d、e中,c最稳定
B. b→a+c反应的活化能为反应物能量减生成物能量
C. b→a+d反应的热化学方程式为:3ClO-(aq)=ClO3-(aq)+2Cl-(aq)ΔH=+116 kJ·mol-1
D. 一定温度下,Cl2与NaOH溶液反应生成的产物有a、b、d,溶液中a、b、d的浓度之比可能为11∶1∶2
难度: 中等查看答案及解析
-
浓度均为0.1 mol/L体积均为Vo的HX、HY溶液,分别加水稀释至体积V, pH 随V的变化关系如下图所示。下列叙述不正确的是
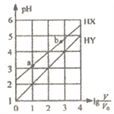
A. HX的酸性比HY的弱,且HY是强酸
B. NaX溶液中存在关系: c(X-)+c(HX)= c(Na+)
C. 相同温度下,电离常数K(HX): a=b
D.
,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则
减小
难度: 中等查看答案及解析