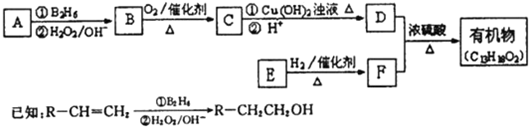
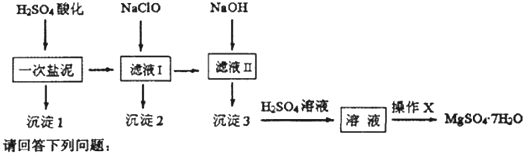
-
化学与环境保护密切相关,下列叙述正确的是( )
A.绿色化学的核心是应用化学原理对环境污染进行治理
B.煤经气化和液化两个物理变化过程,可变为清洁燃料
C.PM2.5(2.5微米以下的颗粒物)的污染主要来自化石燃料的燃烧
D.氢能是清洁能源,工业上电解水法制大量氢气符合节能减排理念难度: 中等查看答案及解析
-
科学工作者发现另一种“足球分子”N60,它的结构与C60相似.下列说法正确的是( )
A.N60和C60互为同素异形体
B.N60是一种新型化合物
C.N60和N2是同素异形体
D.N60和14N都是氮的同系物难度: 中等查看答案及解析
-
下列关于物质的性质与用途的说法中不正确的是( )
A.氧化铝的熔点很高,因此可用做耐火材料
B.某些金属氧化物灼烧时有特殊的颜色,因此可用于制造烟花
C.氢氟酸能与二氧化硅反应,因此可用于刻蚀玻璃
D.氯气具有强氧化性,因此可用于漂白有色布料难度: 中等查看答案及解析
-
在Cu2S+2Cu2O
6Cu+SO2↑反应中,说法正确的是( )
A.Cu2O在反应中被氧化
B.Cu2S在反应中既是氧化剂又是还原剂
C.Cu既是氧化产物又是还原产物
D.若反应中转移12mol电子,则生成6molCu难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.1.7gOH-离子中含有的电子数目为NA
B.常温、常压下,22.4L氧气中含氧原子数目为2NA
C.常温下,0.1molC2H4分子中含共价键数目为0.5 NA
D.含1molH2SO4的浓硫酸和足量的铜反应转移电子数为NA难度: 中等查看答案及解析
-
能实现下列物质间直接转化的元素是( )
单质氧化物
酸或碱
盐.
A.硅
B.氮
C.钠
D.铁难度: 中等查看答案及解析
-
已知Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g)△H<0;则下列叙述不正确的是( )
A.该反应的△H值与反应物用量无关
B.该反应的化学能可以转化为电能
C.反应物的总能量高于生成物的总能量
D.该反应中反应物的化学键断裂放出能量,生成物化学键形成吸收能量难度: 中等查看答案及解析
-
下列各组离子在制定的溶液中一定能大量共存的是( )
A.无色溶液:K+、Al3+、NO3-、AlO2-
B.pH=12的溶液:K+、Cl-、SO32-、SiO32-
C.含0.1mol•L-1 NO3-的溶液:H+、Fe2+、Cl-、SO42-
D.由水电离产生的c(H+)=1×10-12 mol•L-1的溶液:Na+、NH4+、SO42-、HCO3-难度: 中等查看答案及解析
-
如图为完成不同的化学实验所选用的装置或进行的操作,其中正确的是( )
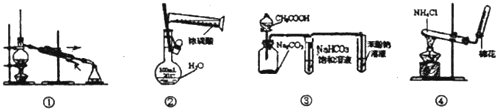
A.装置①可用于分离互不相溶的液体
B.装置②可用于实验室配置一定物质的量浓度溶液
C.装置③可用于验证醋酸、碳酸、苯酚的酸性强弱
D.装置④可用于实验室制备少量氨气难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.铜屑中加入足量氯化铁溶液:Fe3++Cu=Fe2++Cu2+
B.大理石中加入足量浓盐酸:CaCO3+2H+=Ca2++CO2↑+2H2O
C.硫酸溶液中加入足量氢氧化钡溶液:Ba2++OH-+H++SO=BaSO4↓+H2O
D.碳酸氢铵溶液中加入足量氢氧化钠溶液:HCO+OH-=CO
+H2O
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.浓度均为0.1mol•L-1的CH3COOH和CH3COONa溶液等体积混合所得的溶液中:c(CH3COOH)+c(CH3COO-)=0.2mol•L-1
B.0.1mol•L-1NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2(CO32-)
C.0.2mol•L-1HCl溶液与等体积0.1mol•L-1NaOH溶液混合后,溶液的pH=1
D.0.1mol•L-1氨水中滴入0.1mol•L-1盐酸至溶液呈中性时,混合溶液中:c(NH4+)=c(Cl-)难度: 中等查看答案及解析
-
下列实验操作及现象与实验结论一致的是( )
选项 实验操作及现象 实验结论 A 向某溶液中加入盐酸酸化的BaCl2溶液,生成白色沉淀 该溶液中不一定含有SO42- B 光洁的铁钉放在冷的浓硫酸中,无明显现象 铁钉与冷的浓硫酸不反应 C 将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡静置,下层分别呈无色和紫红色 氧化性:Br2>Fe3+>I2 D 向浓度均为0.1mol•L-1的KCl、KI混合溶液中滴加AgNO3 Ksp(AgCl)<Ksp(AgI)
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
观察下列几个装置示意图,有关叙述正确的是( )
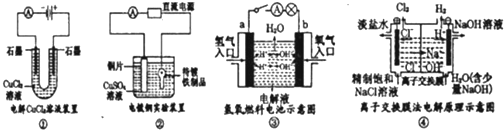
A.装置①中阳极上析出红色固体
B.装置②中铜片应与电源负极相连
C.装置③中外电路电流方向:b极→a极
D.装置④中阴极反应:2 Cl--2e-=Cl2难度: 中等查看答案及解析
-
下列实验过程中产生的现象与图中曲线变化相对应的是( )
A.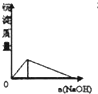
AlCl3滴入NaOH溶液
B.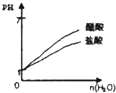
PH=1的醋酸和盐酸分别加水稀释
C.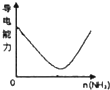
氨气通入醋酸溶液中
D.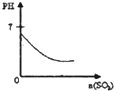
SO2气体通入溴水中难度: 中等查看答案及解析
-
“类推”的思维方式在化学学习与研究中经常采用.下列类推思维中正确的是( )
A.NaOH饱和溶液导电能力强,则Ca(OH)2饱和溶液导电能力也强
B.CaC2能水【解析】
CaC2+2H2O→Ca(OH)2+HC≡CH,则Mg2C2也能水【解析】
Mg2C2+4H2O→2Mg(OH)2+CH3-C≡CH
C.加热时Cu与O2反应生成CuO,则加热时Cu与S反应生成CuS
D.BaCl2溶液中通入SO2无沉淀产生,则Ba(NO3)2溶液中通入SO2也无沉淀产生难度: 中等查看答案及解析
-
在一定条件下,将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中发生下述反应:PCl3(g)+Cl2(g)⇔PCl5(g)
5min末达到平衡,有关数据如表.
下列判断不正确的是( )PCl3(g) Cl2(g) PCl5(g) 初始浓度 2.0 1.0 平衡浓度 C1 C2 0.4
A.若升高温度,反应的平衡常数减小,则正反应为吸热
B.反应5min内,v(PCl3)=0.08 mol•L-1•min-1
C.当容器中Cl2为1.2mol时,可逆反应达到平衡状态
D.平衡后移走2.0mol PCl3和1.0mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol•L-1难度: 中等查看答案及解析