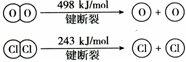
-
下列做法不利于“开源节流”的是
A.开发太阳能、水能、风能、地热能等新能源
B.大力开采煤、石油和天然气,以满足人们日益增长的能源需求
C.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
D.减少资源消耗,注重资源的重复使用、资源的循环再生
难度: 简单查看答案及解析
-
改变外界条件可以影响化学反应速率,针对H2(g)+I2(g)
2HI(g),其中能使活化分子百分数增加的是
①增加反应物浓度 ②增大气体的压强 ③升高体系的温度 ④使用催化剂
A.①② B.②③ C.①④ D.③④
难度: 简单查看答案及解析
-
已知:H2(g)+F2(g)==2HF(g) △H = —270 kJ·mol¯1,下列说法正确的是
A.2L氟化氢气体分解成1L的氢气和1L的氟气吸收270kJ热量
B.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ
C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ
难度: 中等查看答案及解析
-
1000K时,反应C(s)+2H2(g)
CH4(g)的 K=8.28×107,当各气体物质的量浓度分别为H2 0.7 mol·L-1、CH4 0.2 mol·L-1时,上述平衡
A.向正反应方向移动 B.向逆反应方向移动
C.达到平衡 D.无法判断移动方向
难度: 中等查看答案及解析
-
下列反应均为吸热反应,其中一定不能自发进行的是
A.2CO(g) = 2C(s)+O2(g) B.2N2O5(g) = 4NO2(g)+O2(g)
C.MgCO3(s) = MgO(s)+CO2(g) D.(NH4)2CO3(s) = NH4HCO3(s) + NH3(g)
难度: 中等查看答案及解析
-
制取水煤气的反应为C(s)+H2O(g)
CO(g)+H2(g) △H > 0,欲提高反应的速率和C(s)的转化率,可采用的措施为
A.降温 B.增大水蒸气的浓度 C.增大C(s)的量 D.增大压强
难度: 中等查看答案及解析
-
下列事实中,不能用勒夏特列原理解释的是
A.冰镇的啤酒打开后泛起泡沫
B.对N2+3H2
2NH3的反应,使用铁触媒可加快合成氨反应的速率
C.工业制取金属钾Na(l)+KCl(l)
NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
D.氯水中存在如下平衡:Cl2+H2O
HCl+HClO,当加入NaOH溶液后颜色变浅
难度: 中等查看答案及解析
-
在密闭容器中发生反应:aX(g)+bY(g)
cZ(g)+dW(g),反应达到平衡后,保持温度不变,将气体体积压缩到原来的1/2,当再次达到平衡时,W的物质的量浓度为原平衡的1.8倍。下列叙述中不正确的是
A.平衡向逆反应方向移动 B.a + b < c + d
C.Y的体积分数减小 D.X的转化率下降
难度: 中等查看答案及解析
-
在相同温度相同体积的甲、乙两容器中发生反应2SO2(g)+O2(g)
2SO3 (g),甲容器中充入1molSO2和1molO2,乙容器充入2molSO2和2molO2。下列叙述错误的是
A.化学反应速率:乙>甲 B.平衡后O2的浓度:乙>甲
C.平衡后SO2的转化率:乙>甲 D.平衡后混合气体的密度:乙>2甲
难度: 中等查看答案及解析
-
己知丙烷(C3H8)的燃烧热△H=-2215kJ·mol¯1,若一定量的丙烷完全燃烧后生成1.8g水,放出的热量约为
A.55 kJ B.220 kJ C.550 kJ D.1108 kJ
难度: 简单查看答案及解析
-
反应A(g)+B(g)
C(g) +D(g)过程中的能量变化如图所示,正确的是
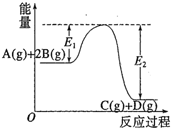
A.该反应是吸热反应
B.当反应达到平衡时,升高温度,A的转化率增大
C.反应体系中加入催化剂对反应热没有影响
D.在反应体系中加催化剂,反应速率增大,E1 、E2均减小
难度: 中等查看答案及解析
-
下列反应既符合图像Ⅰ又符合图像Ⅱ的是

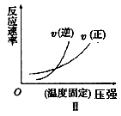
A.N2(g)+3H2(g)
2NH3(g) ΔH<0
B.2SO3(g)
2SO2(g)+O2(g) ΔH>0
C.4NH3(g)+5O2(g)
4NO(g)+6H2O(g) ΔH<0
D.C(s)+H2O(g)
H2(g)+CO(g) ΔH>0
难度: 中等查看答案及解析
-
下列说法正确的是
A.由H原子形成1 mol H—H键要吸收热量
B.C(石墨,s) == C(金刚石,s) ΔH=+1.9 kJ/mol,则可判定金刚石比石墨稳定
C.500℃、30 MPa下,0.5 mol N2(g)和1.5 mol H2(g)反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)
2NH3(g) ΔH=-38.6 kJ/mol
D.已知Ni(CO)4(s)=Ni(s)+4CO(g) ΔH=Q kJ/mol,则Ni(s)+4CO(g)=Ni(CO)4(s) ΔH=-Q kJ/mol
难度: 中等查看答案及解析
-
羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)
COS(g)+H2(g) K=0.1。反应前CO的物质的量为10 mol,平衡后CO物质的量为8 mol,下列说法正确的是
A.建立平衡过程中,CO减少的浓度大于H2S减少的浓度
B.通入CO后重新达平衡,正、逆反应速率均增大
C.反应前H2S物质的量为7 mol
D.CO的平衡转化率为80 %
难度: 中等查看答案及解析
-
在容积固定的容器中发生反应:A(g)+2B(g)
C (g) ΔH<0,各物质浓度如表所示:
浓度
时间
c(A)/mol·L-1
c(B)/mol·L-1
c(C)/mol·L-1
0
0.8
1.6
0
2 min
0.6
x
0.2
4 min
0.3
0.6
0.5
6 min
0.3
0.6
0.5
下列说法错误的是
A.2~4 min内用B表示的平均反应速率为0.3 mol·L-1·min-1
B.反应在第2 min时改变了条件,可能是加入了催化剂
C.反应在第2 min时改变了条件,可能是增加了B的浓度
D.若加入催化剂,平衡时气体混合物的总物质的量保持不变
难度: 中等查看答案及解析
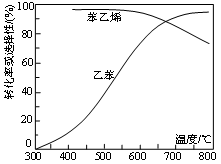
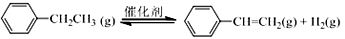 △H=+124 kJ·mol-1,工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。
△H=+124 kJ·mol-1,工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。