-
NH3及其盐都是重要的化工原料.
(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为 .
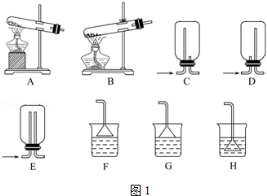
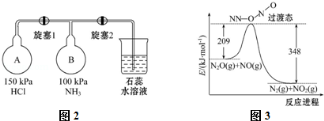
(2)按图2装置进行NH3性质实验.
①先打开旋塞1,B瓶中的现象是 ,原因是 ,稳定后,关闭旋塞1.
②再打开旋塞2,B瓶中的现象是
(3)氨的水溶液显弱碱性,其原因为 (用离子方程式表示).
(4)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为为 ;
若有1mol硝酸铵完全分解,转移的电子数为 mol.
(5)由N2O和NO反应生成N2和NO2的能量变化如图3所示,若生成1mol N2,其△H= kJ•mol﹣1.
-
NH3及其盐都是重要的化工原料。
(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为 、 、 (填字母)。
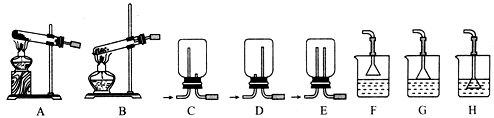
(2)恒定温度下在特制的密闭真空容器中充入2molNH3、1molCO2,发生反应制备氨基甲酸铵 2NH3(g)+CO2(g)  NH2COONH4(s)(假设固体试样体积忽略不计)。若容器体积不变,可以判断该反应已经达到化学平衡的是 (填字母)。
NH2COONH4(s)(假设固体试样体积忽略不计)。若容器体积不变,可以判断该反应已经达到化学平衡的是 (填字母)。
A.υ(NH3)= 2υ(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
上述反应达到平衡后,若在恒温下压缩容器体积,重新达平衡后混合气体中NH3的体积分数 (填“增加”、“减小”或“不变”)。
(3)铵盐在水溶液中建立如下水解平衡:NH4Cl+H2O NH3·H2O+HCl,研究表明,浓度、温度、pH均对铵盐水解程度(即上述反应中中NH4Cl的转化率)产生影响。某兴趣小组探究某一种因素对溶液中NH4Cl水解程度的影响。
NH3·H2O+HCl,研究表明,浓度、温度、pH均对铵盐水解程度(即上述反应中中NH4Cl的转化率)产生影响。某兴趣小组探究某一种因素对溶液中NH4Cl水解程度的影响。
试剂与仪器:固体NH4Cl、蒸馏水、100 mL容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、pH计、温度计、恒温水浴槽(可控制温度)。
设计实验方案,pH为拟测定的数据,表中V(溶液)表示所配制NH4Cl溶液的体积。
| 物理量 实验序号 | V(溶液)/mL | NH4Cl /g | 温度/℃ | pH | … |
| 1 | 100 | m | T1 | | … |
| 2 | 100 | m | T2 | | … |
| 3 | 100 | 2m | T2 | | … |
请分析,实验1、2的目的是探究 对溶液中NH4Cl水解程度的影响,实验2、3的目的是探究 对溶液中NH4Cl水解程度的影响。
-
NH3及其盐都是重要的化工原料。
(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为________。

(2)如图,装置进行NH3性质实验,A、B为体积相等的两个烧瓶。
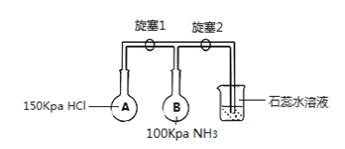
①先打开旋塞1,B瓶中的现象是___________________________,稳定后,关闭旋塞1;
②再打开旋塞2,B瓶中的现象是___________________________。
(3)为了探究某一种因素对溶液中NH4Cl水解程度的影响,限制使用的试剂与仪器为固体NH4Cl,蒸馏水、100mL容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、PH计、温度计、恒温水浴槽(可控制温度),某同学拟定了如下实验表格:
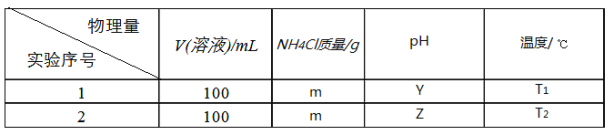
①该同学的实验目的是探究_____________对溶液中NH4Cl水解程度的影响。
②按实验序号1所拟数据计算NH4Cl水解反应的平衡转化率为___________(只列出算式,忽略水自身电离的影响)。
-
如右图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用于
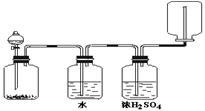
A.浓硝酸和铜反应制备NO2
B.浓氨水和生石灰反应制备氨气
C.锌和盐酸反应制备氢气
D.碳酸钙和盐酸反应制备二氧化碳
-
如图是产生和收集气体的实验装置,该装置不适合于
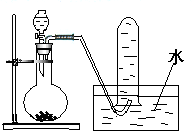
A.用盐酸与CaCO3反应制取CO2 B.用稀硫酸和锌反应制取H2
C.用NH4Cl和Ca(OH)2反应制取NH3 D.用H2O2溶液和MnO2反应制取O2
-
图是产生和收集气体的实验装置,该装置适合于
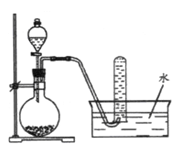
A.用浓硝酸与Cu反应制取NO2
B.用浓盐酸和MnO2反应制取Cl2
C.用NH4Cl溶液和Ca(OH)2反应制取NH3
D.用H2O2溶液和MnO2反应制取O2
-
关于下列各图的叙述,正确的是( )
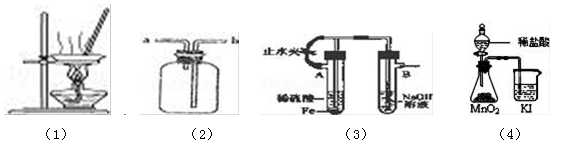
A.用图(1)所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
B.用图(2)所示装置可收集H2、NH3、NO等气体
C.用图(3)所示装置能较长时间观察到Fe(OH)2白色沉淀
D.用图(4)所示装置能比较MnO2、Cl2、I2的氧化性
-
实验室制备氯气的装置如下图。图中涉及气体发生、除杂、干燥、收集、尾气处理装置,其中错误的是( )
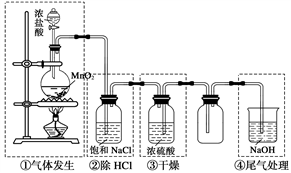
A. ① B. ② C. ③ D. ④
-
下列实验装置中不能达到实验目的是 ( )
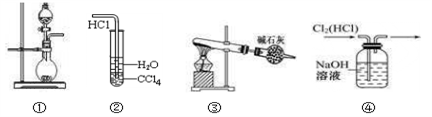
A. 装置①可用于制取H2、CO2或NH3
B. 装置②可用于氯化氢气体溶于水
C. 装置③可用于以NH4Cl和Ca(OH)2固体为原料,实验室制NH3
D. 装置④可用于除去Cl2中的HCl
-
下图是产生和收集气体的实验装置,该装置不适合于

A.用锌和盐酸制取H2
B.用NH4Cl和Ca(OH)2制取NH3
C.用电石和饱和食盐水制取C2H2
D.用H2O2在MnO2催化下制O2

NH2COONH4(s)(假设固体试样体积忽略不计)。若容器体积不变,可以判断该反应已经达到化学平衡的是 (填字母)。
NH3·H2O+HCl,研究表明,浓度、温度、pH均对铵盐水解程度(即上述反应中中NH4Cl的转化率)产生影响。某兴趣小组探究某一种因素对溶液中NH4Cl水解程度的影响。











