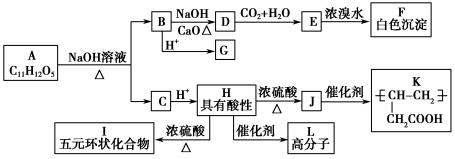
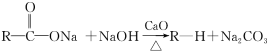-
有机物A的分子式为C5H12O2,则符合下列条件的有机化合物A有(不考虑立体异构)( )
①1 mol A可与金属钠反应放出1 mol氢气 ②含2个甲基 ③1个碳原子上不能连接2个羟基
A.7种 B.6种 C.5种 D.4种
难度: 困难查看答案及解析
-
化学与人类生产、生活、环境保护及社会可持续发展密切相关,下列有关叙述正确的是( )
A.绿色化学的核心是应用化学原理对环境污染进行治理
B.PM2.5表面积大,能吸附大量的有毒有害物质,对人的肺功能造成很大危害
C.二氧化硅广泛应用于太阳能电池、计算机芯片
D.汽车尾气中含有大量大气污染物,这是汽油不完全燃烧造成的
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,5.6 L O2作氧化剂时转移电子数一定为NA
B.用惰性电极电解CuSO4溶液后,如果加入0.1 mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA
C.已知3BrF3+5H2O=HBrO3+Br2+9HF+O2↑ 如果有5 mol H2O参加氧化还原反应,则由水还原的BrF3分子数目为3NA
D.142 g Na2SO4和Na2HPO4固体混合物中,阴阳离子总数为3NA
难度: 困难查看答案及解析
-
高铁酸钠(Na2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强、无二次污染的绿色水处理剂。工业制高铁酸钠的方法有如下两种:湿法制备的主要离子反应为2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,干法制备的主要反应方程式为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑。则下列有关说法不正确的是( )
A.高铁酸钠中铁显+6价
B.湿法中FeO42-是氧化产物
C.干法中每生成1 mol Na2FeO4转移4 mol电子
D.Na2FeO4可氧化水中的H2S、NH3,生成的Fe(OH)3胶体还能吸附悬浮杂质
难度: 简单查看答案及解析
-
碱性硼化钒(VB2)—空气电池工作时反应为:4VB2 + 11O2=4B2O3 + 2V2O5。用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )
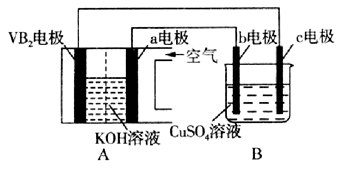
A.电解过程中,c电极表面先有红色物质析出,然后有气泡产生
B.VB2电极发生的电极反应为:2VB2 + 11H2O - 22e-=V2O5 + 2B2O3 + 22H+
C.外电路中电子由c电极流向VB2电极
D.若B装置内的液体体积为200 mL,则CuSO4溶液的物质的量浓度为0.1 mol/L
难度: 困难查看答案及解析
-
化工生产中常用FeS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+FeS(s)
CuS(s)+Fe2+(aq)下列有关叙述中正确的是( )
①FeS的Ksp大于CuS的Ksp
②该反应平衡常数K=
③溶液中加入少量Na2S固体后,溶液中c(Cu2+)、c(Fe2+)保持不变
④达到平衡时c(Fe2+)=c(Cu2+)
A.②③ B.①③④ C.①② D.②③④
难度: 困难查看答案及解析
-
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g·L-1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是( )
A.原子半径:W>Z>Y>X>M
B.YZ2溶于水形成的溶液具有较强的氧化性
C.1molWM溶于足量水中完全反应共转移2mol电子
D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键
难度: 中等查看答案及解析