-
在“十二五”期间,江苏省将大力实施“清水蓝天”工程.下列不利于“清水蓝天”工程实施的是( )
A.积极推广太阳能、风能、地热能及水能等的使用,减少化石燃料的使用
B.加强城市生活污水脱氮除磷处理,遏制水体富营养化
C.加大稀土资源的开采和出口,保证经济快速发展
D.大力实施矿物燃料“脱硫、脱硝技术”,减少硫的氧化物和氮的氧化物污染难度: 中等查看答案及解析
-
下列化学用语或模型图不正确的是( )
A.HCN的结构式为H-C≡N
B.Na2O2的电子式:
C.具有16个质子、16个中子和18个电子的微粒是
D.乙烯的比例模型:难度: 中等查看答案及解析
-
下列有关物质的性质、应用或制取的说法正确的是( )
A.常温下浓硝酸与铝不反应,可用铝制容器存放浓硝酸
B.除去氯化钙溶液中少量盐酸,加入足量碳酸钙粉末,充分搅拌再过滤
C.自来水厂可用硫酸铁对水进行消毒杀菌
D.水晶项链和餐桌上的瓷盘都是硅酸盐制品难度: 中等查看答案及解析
-
下列离子方程式不正确的是( )
A.用SO2水溶液吸收Br2:SO2+Br2+2H2O═4H++S+2Br-
B.漂白粉溶液露置在空气中失效:ClO-+CO2+H2O═HClO+HC
C.1mol/L的NaAlO2溶液和2.5mol/L的HCl溶液等体积混合:2Al+5H+═Al(OH)3↓+Al3++H2O
D.用惰性电极电解硫酸铜溶液:2Cu2++2H2O2Cu↓+O2↑+4H+
难度: 中等查看答案及解析
-
下列有关工业生产的叙述中,正确的是( )
A.海水提镁:
B.海水提溴:
C.工业制硫酸:
D.工业合成氨:难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,22.4 L氯气与足量NaOH溶液反应转移电子数为NA
B.8.7 g MnO2与40 mL 10 mol/L的浓盐酸充分反应,生成的氯气分子数为0.1NA
C.常温常压下,21 g氧气和27 g臭氧所含氧原子总数为3NA
D.500 mL 1.0 mol•L-1的NH4Cl溶液中含有N的数目为0.5 NA
难度: 中等查看答案及解析
-
下列各组离子在指定的溶液中能大量共存的是( )
A.c(Al3+)=0.1 mol•L-1的溶液中:Na+、Cl-、Al、S
B.能使甲基橙变红的溶液中:Na+、N、S
、N
C.c(H+)/c(OH-)=1012的溶液中:N、K+、HC
、N
D.c(I-)=0.1 mol/L的溶液中:Na+、Fe3+、ClO-、S难度: 中等查看答案及解析
-
下列实验能够达到实验目的是( )
A.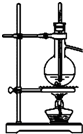
分离沸点相差较大的互溶液体混合物
B.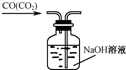
除去CO气体中得CO2气体
C.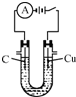
电解饱和食盐水制氯气和氢气
D.
比较KMnO4、Cl2和S氧化性难度: 中等查看答案及解析
-
下列说法错误的是( )
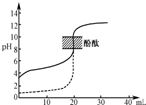
A.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
B.反应NH3(g)+HCl(g)═NH4Cl(s);△H<0,在任何条件下均能自发进行
C.锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后再用酸溶解去除
D.用0.1 mol/L NaOH溶液分别滴定相同物质的量浓度和相同体积的盐酸和醋酸,其中虚线表示的是滴定盐酸的曲线难度: 中等查看答案及解析
-
X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物.下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )
选项 X Y Z 甲 乙 A H2 Si Cl2 SiCl4 HCl B Mg C O2 CO2 MgO C Zn Fe Cl2 FeCl2 ZnCl2 D O2 N2 H2 NH3 H2O 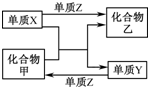
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列对实验现象及操作的解释合理的是( )
操作及现象 解释 A KI淀粉溶液中滴入氯水变蓝,再通入SO2,褪色 SO2具有漂白性 B 配制FeCl3溶液时需加入少量盐酸 盐酸能抑制Fe3+的水解 C 某钠盐溶液中加入盐酸酸化的硝酸钡溶液有白色沉淀 说明该钠盐是硫酸钠或硫酸氢钠 D 向含有少量的FeBr2的FeCl2溶液中,加入适量氯水,再加CCl4萃取分液 除去FeCl2溶液中的FeBr2
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
图1为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,图2为电解AlCl3溶液的装置,电极材料均为石墨.用该装置进行实验,反应开始后观察到x电极附近出现白色沉淀.下列说法正确的是( )
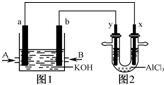
A.图1、图2中电解质溶液的pH均增大
B.图2中电解AlCl3溶液的总反应为:2Cl-+2H2OCl2↑+H2↑+2OH-
C.A处通入的气体为CH4,电极反应式为CH4+10OH--8e-═CO32-+7H2O
D.燃料电池内部OH-向a极移动,电解池中Cl-向y极移动难度: 中等查看答案及解析
-
下列溶液中微粒的物质的量浓度关系正确的是( )
A.0.1 mol/L NaHS溶液:c(OH-)=c(H+)+2c(H2S)+c(HS-)
B.1 L 0.1 mol•L-1(NH4)2Fe(SO4)2•6H2O的溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-)
C.25℃时,pH=9.4,浓度均为0.10 mol/L的HCN与NaCN的混合溶液:c(Na+)>c(CN-)>c(HCN)>c(OH-)
D.浓度均为0.1 mol/L的Na2CO3与NaHCO3混合溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)难度: 中等查看答案及解析
-
在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示.则下列有关推断正确的是 ( )
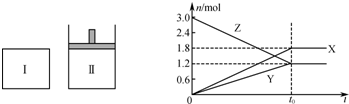
A.该反应的化学方程式为3X+2Y⇌2Z
B.若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间大于t
C.若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态
D.若达平衡后,对容器Ⅱ升高温度时其体积增大,说明Z发生的反应为吸热反应难度: 中等查看答案及解析
-
研究性学习小组进行了一系列化学实验后,发现高锰酸钾分解后的含锰元素的化合物都能和浓盐酸反应制得氯气,且锰化合物的还原产物都是MnCl2.他们将6.32gKMnO4粉末加热一段时间,也不知道高锰酸钾是否完全分解,收集到0.112L气体后便停止加热了,冷却后放入足量的浓盐酸再加热,又收集到气体体积是(上述气体体积都折合成标准状况)( )
A.0.448L
B.2.240L
C.2.016L
D.无法确定难度: 中等查看答案及解析