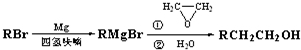
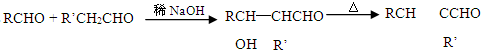-
下列说法中,正确的是( )
A.CO、NO都是大气污染物,在空气中都能稳定存
B.SiO2是酸性氧化物,能与NaOH溶液反应
C.溶液、胶体和悬浊液的本质区别是分散质微粒是否带电荷
D.日本核泄漏产生了I原子,其中子数比
的中子数少2
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的数值,下列说法中,正确的是( )
A.标准状况下,22.4L Cl2完全溶于水时,转移的电子数为NA
B.常温下,1L pH=1的H2SO4溶液中含有H+的数目为0.2NA
C.标准状况下,2.24L NH3中含有的共价键数目为NA
D.常温下,23g NO2和N2O4的混合气体中含有NA个氧原子难度: 中等查看答案及解析
-
下列说法中,正确的是( )
A.离子化合物中,阴、阳离子间存在静电吸引力
B.HF、HCl、HBr和HI的热稳定性和还原性从左到右依次减弱
C.第三周期非金属元素对应的含氧酸从左到右以此增强
D.短周期元素形成离子后,最外层电子数都达到8电子稳定结构难度: 中等查看答案及解析
-
下列说法中,正确的是( )
A.实验室可以用氢氧化钠溶液出去乙酸乙酯中的乙酸杂质
B.乙烯和聚乙烯都可以和溴水发生加成反应
C.汽油、柴油和植物油的主要成分都是碳氢化合物
D.分子式同为C3H7Cl,但沸点不同的分子共有两种难度: 中等查看答案及解析
-
下列实验操作及现象能够达到对应实验目的是( )
选项 实验操作及现象 实验目的 A 将SO2通入品红溶液中,品红溶液褪色;加热褪色后的品红溶液,溶液恢复红色 验证亚硫酸的不稳定性 B 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有少量气泡产生 证明常温下
Ksp(BaCO3)>Ksp(BaSO4)C 常温下,测定物质的量浓度相同的盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH 证明相同条件下,在水溶液中HCl电离程度大于CH3COOH D 将浓硫酸与碳混合加热,直接将生成的气体通入足量的石灰水,石灰水变浑浊 检验气体产物种CO2的存在
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列关于常温下电解质溶液的叙述中,正确的是( )
A.碳酸氢铵溶液和足量的氢氧化钠溶液混合的离子反应:HCO3-+OH-=CO32-+H2O
B.等物质的量浓度、等体积的氨水和盐酸混合后,c(H+)+c(NH4+)=c(Cl-)+c(OH-)
C.等物质的量浓度的NH4Cl溶液和NH3•H2O溶液,溶液中c(NH4+)前者小于后者
D.25℃时,pH=8的0.1mol•L-1 NaX溶液中由水电离出的c (OH-)=1×10-8mol•L-1难度: 中等查看答案及解析
-
常温下,向100mL 0.01mol•L-1 HA溶液中逐滴加入0.02 mol•L-1 MOH溶液,图中所示的曲线表示混合溶液的pH变化情况(溶液体积变化勿略不计).下列说法中,不正确的是( )
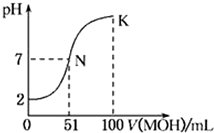
A.HA为一元强酸
B.MOH为一元弱碱
C.N点水的电离程度小于K点水的电离程度
D.K点对应的pH=10,则有c(MOH)+c(OH-)-c(H+)=0.005mol•L-1难度: 中等查看答案及解析