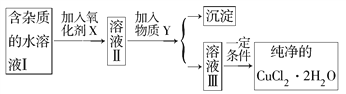
-
下列事实、事件、事故中与甲烷有无关的是
A. 天然气的主要成分 B. 石油经过催化裂化及裂解后的产物
C. “西气东输”中气体 D. 煤矿中的瓦斯爆炸
难度: 简单查看答案及解析
-
在298 K、100 kPa时,已知:
2H2O(g)=O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)=2HCl(g) ΔH2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是
A.ΔH3=ΔH1-ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1+2ΔH2
难度: 中等查看答案及解析
-
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是( )
A. pH=4的醋酸中:c(H+)=4.0mol•L-1
B. 饱和小苏打溶液中:c(Na+)=c(HCO3-)
C. 饱和食盐水中:c(Na+)+ c(H+)=c(Cl-)+c(OH-)
D. pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol•L-1
难度: 中等查看答案及解析
-
下列关于有机化合物的说法完全正确的是
A. 有机化合物都是非电解质 B. 有机化合物都不能溶于水
C. 有机化合物都能燃烧 D. 有机化合物都含有碳元素
难度: 中等查看答案及解析
-
下列说法正确的是
A. 强电解质都是离子化合物,而弱电解质都是共价化合物
B. 中和pH值相等、体积相等的盐酸和醋酸,盐酸所消耗的氢氧化钠少
C. 将氢氧化钠和氨水溶液各稀释一倍,两者的OH-浓度均减小到原来的1/2
D. 常温下,pH为12的溶液一定是碱溶液
难度: 中等查看答案及解析
-
下列烷烃中可能存在同分异构体的是
A. 甲烷 B. 乙烷 C. 丙烷 D. 丁烷
难度: 简单查看答案及解析
-
甲烷在光照的条件下与氯气混和,最多可以生成几种物质
A. 2种 B. 3种 C. 4种 D. 5种
难度: 中等查看答案及解析
-
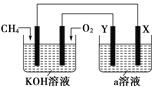
关于下列装置说法正确的是
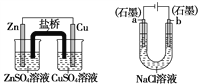
① ② ③ ④
A. 装置①中,盐桥中的K+移向ZnSO4溶液
B. 装置②工作一段时间后,a极附近溶液的OH-浓度增大
C. 用装置③精炼铜时,c极为粗铜
D. 装置④中电子由Zn流向Fe,装置中有Fe2+生成
难度: 中等查看答案及解析
-
我国某大城市今年夏季多次降下酸雨。据环保部门测定,该城市整个夏季酸雨的pH平均
为3.2。在这种环境中的铁制品极易被腐蚀。对此条件下铁的腐蚀的叙述不正确的是
A. 此腐蚀过程有化学腐蚀也有电化学腐蚀
B. 在化学腐蚀过程中有氢气产生
C. 发生电化学腐蚀时的正极反应为2H2O+O2+4e-===4OH-
D. 发生电化学腐蚀时的负极反应为Fe-2e-===Fe2+
难度: 中等查看答案及解析
-
在约100 ℃的温度下,NaCl稀溶液中[H+]为1.0×10-6 mol·L-1。下列说法中正确的是
①该NaCl溶液显酸性 ②该NaCl溶液显中性 ③该NaCl溶液中KW=1×10-14mol2·L-2
④该NaCl溶液中KW=1×10-12mol2·L-2 ⑤该NaCl溶液pH=7
A. ②④ B. ①③ C. ①④ D. ②⑤
难度: 简单查看答案及解析
-
下列各组离子一定能大量共存的是
A. 含有大量HCO
的澄清透明溶液中:K+、Cl-、Na+、SO
B. 能与金属铝反应放出氢气的溶液中:K+、NO
、Cl-、Fe2+
C. 常温下水电离出的c(H+)·c(OH-)=10-20的溶液中:Na+、ClO-、S2-、NH
D. pH=7的溶液:Fe3+、Mg2+、SO
、Cl-
难度: 中等查看答案及解析
-
下列能发生的反应中,离子方程式正确的是
A. 硫酸与Ba(OH)2溶液混合:Ba2++OH-+H++SO
===H2O+BaSO4↓
B. 足量的氯气通入FeBr2溶液中:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
C. 碳酸钙和盐酸混合:CO
+2H+===CO2↑+H2O
D. MgCl2溶液中通入二氧化碳:Mg2++CO2+H2O===MgCO3↓+2H+
难度: 简单查看答案及解析
-
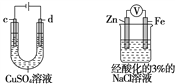
按如图所示的装置进行实验:A极是铜锌合金,B极是纯铜,电解质溶液中含有足量的铜离子,通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68 g,溶液质量增加0.03 g,则A合金中Cu、Zn的物质的量之比为
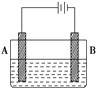
A. 4∶1 B. 3∶1 C. 2∶1 D. 1∶1
难度: 中等查看答案及解析
-
下列大小比较正确的是
A. 等体积、等物质的量浓度的NaCl(aq)离子总数小于NaClO(aq)中离子总数
B. 25 ℃时,pH=3的硫酸溶液中水的电离程度大于pH=11的氨水中水的电离程度
C. 0.1 mol·L-1(NH4)2CO3溶液中的c(NH
)大于0.1 mol·L-1的NH4Cl溶液中的c(NH
)的2倍
D. 常温下,将醋酸钠、盐酸两溶液混合后,溶液呈中性,溶液中c(Na+)大于c(Cl-)
难度: 中等查看答案及解析
-
为确定某溶液的离子组成,进行如下实验:
①测定溶液的pH,溶液显强碱性 ②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体 ③在②实验后的溶液中再滴加Ba(NO3)2溶液,产生白色沉淀 ④取③实验后的上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀
根据实验判断,以下推测正确的是
A. 一定有SO32- B. 一定有HCO3-
C. 不能确定Cl-是否存在 D. 不能确定CO32-是否存在
难度: 简单查看答案及解析
-
下列关于有机物的命名中不正确的是
A. 2─二甲基戊烷 B. 2─乙基戊烷
C. 3,4─二甲基庚烷 D. 3─甲基己烷
难度: 中等查看答案及解析
-
在铁片上镀锌时,下列叙述正确的是
①将铁片接在电池的正极上 ②将锌片接在电池的正极上 ③在铁片上发生的反应是:Zn2++2e-→Zn ④在锌片上发生的反应是:4OH- - 4e- →O2↑+2H2O ⑤需用FeSO4溶液 ⑥需用ZnSO4溶液
A. ②③⑥ B. ②③④⑥. C. ①④⑤ D. ①③⑥
难度: 中等查看答案及解析