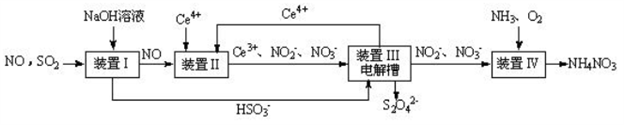
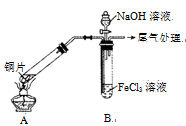
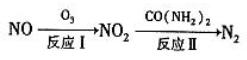-
不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是( )
序号
甲
乙
丙
①
CO2
SO2
石灰水
②
HCl
CO2
石灰水
③
CO2
SO2
Ba(NO3)2
④
NO2
SO2
BaCl2
⑤
CO2
NH3
CaCl2
A. ②③④ B. ②③④⑤ C. ①③④ D. ①②③④
难度: 中等查看答案及解析
-
下列实验操作能达到相应实验目的的是( )
选项
实验操作
实验目的
A
将二氧化硫气体通入紫色石蕊试液中,观察溶液颜色变化
证明二氧化硫具有漂白性
B
向2mL 1 mol·L-1NaOH溶液中先加入3滴1 mol·L-1 FeCl3,再加入3滴1 mol·L-1MgCl2溶液
证明K[Mg(OH)2]> K[Fe(OH)3]
C
相同条件下,向两支盛有相同体积不同浓度H2O2溶液的试管中分别滴入适量相同浓度的CuSO4溶液和FeCl3溶液
探究Cu2+、Fe3+对H2O2分解速率的影响
D
向2mL品红溶液和2mL加入少许醋酸的品红溶液中分别滴入3滴NaClO的84消毒液,观察红色褪色的快慢
证明溶液pH的减少,84消毒液的氧化能力增强
难度: 困难查看答案及解析
-
下列有关Ca(ClO)2溶液的叙述正确的是
A.该溶液中,K+、Cl-、CH3COOH、I-可以大量共存
B.与Na2SO3溶液反应的离子方程式:ClO- + SO32- = SO42- + Cl-
C.不可使用pH试纸测定该溶液的pH
D.1L 0.1 mol·L-1该溶液和足量的CO2充分反应,产生10 g沉淀
难度: 简单查看答案及解析
-
卤族元素及其化合物在生活中应用广泛。 下列有关说法正确的是( )
A. 氟氯烃作制冷剂会加剧雾霾天气的形成
B. 只通过电解的方法就能实现从食盐水到“84” 消毒液的生产
C. 加碘食盐中含有碘元素, 能使淀粉溶液变蓝
D. 工业上制漂白粉, 所得的氯化物都具有漂白性
难度: 简单查看答案及解析
-
X、Y、Z、W四种物质在一定条件下具有如图所示的转化关系,下列判断正确的是
A.若图中反应均为非氧化还原反应,当W为一元强碱时,则X可能是NaAlO2
B.若图中反应均为非氧化还原反应,当W为一元强酸时,则X可能是NH3
C.若图中反应均为氧化还原反应,当W为非金属单质时,则Z可能是CO2
D.若图中反应均为氧化还原反应,当W为金属单质时,则Z可能是FeCl3
难度: 中等查看答案及解析
-
下列图像正确的是( )

A. A B. B C. C D. D
难度: 困难查看答案及解析
-
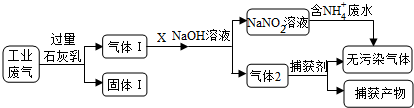
二氧化氯(ClO2)是一种黄绿色易溶于水的气体,常用作饮用水消毒。实验室通过如下过程制备二氧化氯。下列说法正确的是
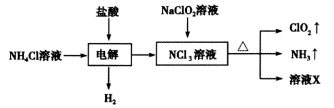
A. 电解时发生反应的离子方程式为:NH4++3Cl-
2H2↑+NCl3
B. 溶液X中大量存在的阴离子有Cl-、OH-
C. 可用饱和食盐水除去ClO2中的NH3
D. 可用明矾除去饮用水中残留的NaClO2
难度: 中等查看答案及解析