-
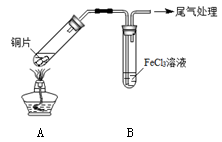
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示。

(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验。
| 步骤① | 配制1 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1, 取少量装入试管B中,加热A 取少量装入试管B中,加热A |
FeCl3溶液显酸性的原因是_______________________(用离子方程式表示)。写出装置A中产生SO2的化学方程式:______________________。
(2)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔效应。将混合液放置12小时,溶液才变成浅绿色。
【资料】[Fe(HSO3)]2+离子为红棕色,它可以将Fe3+还原为Fe2+。生成[Fe(HSO3)]2+离子的反应为可逆反应。
解释SO2与FeCl3溶液反应生成红棕色[Fe(HSO3)]2+的原因:_____________________。
写出溶液中[Fe(HSO3)]2+离子与Fe3+反应的离子方程式:_________________。
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤②③的实验。
| 步骤② | 往5 mL 1 mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色 |
| 步骤③ | 往5 mL重新配制的1 mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO 2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色 2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色 |
用铁氰化钾K3[Fe(CN)6] 溶液检验步骤②和步骤③所得溶液中的Fe2+,其现象为______________
(4)综合上述实验探究过程,可以获得的实验结论:
Ⅰ.SO2与FeCl3溶液反应生成红棕色中间产物[Fe(HSO3)]2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.___________________ ___ _______。
___ _______。
-
(12分)某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示。
(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验。
| 步骤① | 配制1 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A。 |
FeCl3溶液显酸性的原因是_________。写出装置A中产生SO2的化学方程式:_________。
(2)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。
【查阅资料】 Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。生成Fe(HSO3)2+离子的反应为可逆反应。
解释SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因:_____________________。
写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式:______________________________。
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤③的实验。
| 步骤② | 往5mL1mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色。 |
| 步骤③ | 往5mL重新配制的1mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 |
用铁氰化钾溶液检验步骤②和步骤③所得溶液中的Fe2+,其现象为_______________。
(4)综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
II.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
III._________________________________。
-
某化学兴趣小组为验证SO2的还原性,特邀你参与以下探究活动。
I.理论预测
该兴趣小组实验实施前进行了充分的讨论交流,确定选择SO2和FeCl3溶液的反应来探究,并预测将SO2通入FeCl3溶液中的现象。小组同学想听听你的分析,你认为可能观察到的现象是:_____________,你预测的理论依据是(用离子方程式表示):________________________。
II.实验探究
(1)配制1mol/LFeCl3溶液(未用盐酸酸化)
①下面是小组四位同学在配制溶液时的“转移”操作,其中正确的是:_______________。
②测溶液的pH得知溶液呈酸性,其原因是:____________________ (用离子方程式表示)。
(2)SO2通入FeCl3溶液至饱和,观察到溶液由棕黄色变为红棕色,并没有观察到预期的现象。将反应后的溶液放置12小时后又出现了预期的结果。
查阅资料得知[Fe(HSO3)]2+为红棕色,生成[Fe(HSO3)]2+的反应为可逆反应。请你用化学方程式解释将SO2通入FeCl3溶液至饱和时观察到的现象:_______________。
(3)为了探究如何缩短红棕色变为预期颜色的时间,小组继续探究:另取少量FeCl3溶液,再通入SO2溶液变为红棕色,加浓HCl酸化,几分钟后变为预期颜色。
请你推测小组在实验方案设计中“加浓HC1酸化”的目的是:_______________。
III.感悟与分享
通过探究,小组同学深受启发、感悟良多。比如,有同学认为“实验才是化学的最高法庭”。请写出一种你的感悟与同学分享:______________________。
-
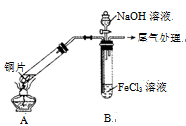
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如右图所示(夹持仪器已略去)。
(1)实验前,应先检查装置的 ;实验中产生的尾气应通入 溶液进行处理。
(2)实验过程中需要配制100 mL l mo1·L-1 FeCl3溶液,所需要的玻璃仪器有:烧杯、量筒、玻璃棒、 ;实际配制过程中,常先将FeCl3固体完全溶于适量稀盐酸中,再加水稀释,此特殊操作的目的是____。
(3)该小组同学向5 mL l mo1·L-1 FeCl3溶液中通入足量的SO2,溶液最终呈浅绿色,写出其反应的离子方程式 。再打开分液漏斗活塞,逐滴加入煮沸冷却后的NaOH稀溶液,则试管B中产生的实验现象是 。
(4)该小组同学在(3)中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔效应,最终溶液呈浅绿色。
【查阅资料】Fe(HSO3)2+在溶液中呈红棕色且具有较强的还原性,能被Fe3+氧化为SO42-。则Fe(HSO3)2+与Fe3+在溶液中反应的离子方程式是 。
(5)若实验中用5 mL一定浓度的浓H2SO4与适量Cu片充分反应,实验结束后,测得产生SO2的体积在标准状况下为672 mL,向已冷却的A试管溶液中加入4 mo1·L-1的NaOH溶液30 mL时,恰好使Cu2+完全沉淀。则所用浓H2SO4浓度为____。(忽略过程中溶液的体积变化)
-
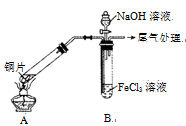
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如右图所示(夹持仪器已略去)。
(1)实验前,应先检查装置的 ;实验中产生的尾气应通入 溶液进行处理。
(2)实验过程中需要配制100 mL l mo1·L-1 FeCl3溶液,所需要的玻璃仪器有:烧杯、量筒、玻璃棒、 ;实际配制过程中,常先将FeCl3固体完全溶于适量稀盐酸中,再加水稀释,此特殊操作的目的是____。
(3)该小组同学向5 mL l mo1·L-1 FeCl3溶液中通入足量的SO2,溶液最终呈浅绿色,写出其反应的离子方程式 。再打开分液漏斗活塞,逐滴加入煮沸冷却后的NaOH稀溶液,则试管B中产生的实验现象是 。
(4)该小组同学在(3)中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔效应,最终溶液呈浅绿色。
【查阅资料】Fe(HSO3)2+在溶液中呈红棕色且具有较强的还原性,能被Fe3+氧化为SO42-。则Fe(HSO3)2+与Fe3+在溶液中反应的离子方程式是 。
(5)若实验中用5 mL一定浓度的浓H2SO4与适量Cu片充分反应,实验结束后,测得产生SO2的体积在标准状况下为672 mL,向已冷却的A试管溶液中加入4 mo1·L-1的NaOH溶液30 mL时,恰好使Cu2+完全沉淀。则所用浓H2SO4浓度为____。(忽略过程中溶液的体积变化)
-
(15分)某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去)。
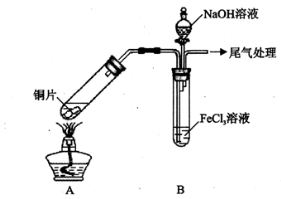
(1)实验前,应先检查装置的 ;实验中产生的尾气应通人 溶液。
(2)实验过程中需要配制100mL1mol/L FeCl3溶液(未用浓盐酸酸化),所需要的玻璃仪器有:烧杯、量筒、玻璃棒、 。
(3)该小组同学向5mL lmol/L FeCl3溶液中通人足量的SO2,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是 。
(4)该小组同学在(3)中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象,最终溶液呈浅绿色。
【查阅资料】Fe(HSO3)2+离子在溶液中呈红棕色且具有较强的还原性,能被Fe3+氧化为SO 。
。
Fe(HSO3)2+与Fe3+在溶液中反应的离子方程式是 。
(5)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了如下实验:

向步骤①和步骤②所得溶液中加入某种试剂,溶液立即出现蓝色沉淀,则该试剂中含有溶质的化学式是 。
(6)综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ. 。
-
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去)。
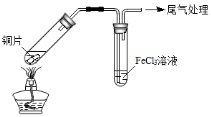
A B
(1)实验前,应先检查装置的 ;实验中产生的尾气应通入 溶液。
(2)实验过程中需要配制100mL1mol/L FeCl3溶液(未用浓盐酸酸化),所需要的玻璃仪器有:烧杯、量筒、胶头滴管、玻璃棒、 。
(3)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验。
| 步骤① | 配制1 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装 入试管B中,加热A。 入试管B中,加热A。 |
写出装置A中产生SO2的化学方程式: 。
(4)当SO2通 入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。
入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。
【查阅资料】 Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。生成Fe(HSO3)2+离子的反应为可逆反应。
解释SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因(用化学用语解释): 。
写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式:  。
。
(5)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学 进行了步骤③的实验。
进行了步骤③的实验。
| 步骤② | 往5mL1mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶 液颜色变为浅绿色。 液颜色变为浅绿色。 |
| 步骤③ | 往5mL重新配制的1mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO 2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 |
⑹综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
II.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
III. 。
-
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去)。
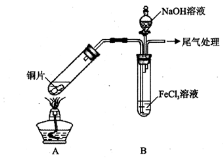
(1)实验前,应先检查装置的 ;实验中产生的尾气应通入 溶液。
(2)实验过程中需要配制100mL1mol/L FeCl3溶液,所需要的玻璃仪器有:烧杯、量筒、玻璃棒、 。
(3)该小组同学向5mL lmol/L FeCl3溶液中通入足量的SO2,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是 。
(4)该小组同学在(3)中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象,最终溶液呈浅绿色。
【查阅资料】Fe(HSO3)2+离子在溶液中呈红棕色且具有较强的还原性,能被Fe3+氧化为SO 。SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因是 ;Fe(HSO3)2+与Fe3+在溶液中反应的离子方程式是 。
。SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因是 ;Fe(HSO3)2+与Fe3+在溶液中反应的离子方程式是 。
(5)若实验中用5 mL一定浓度的浓H2SO4与适量Cu片充分反应,实验结束后,测得产生SO2的体积在标准状况下为672 mL,向已冷却的A试管溶液中加入4 mo1·L-1的NaOH溶液30 mL时,恰好使Cu2+完全沉淀。则所用浓H2SO4浓度为________________。(忽略过程中溶液的体积变化)
-
某化学兴趣小组为验证SO2的还原性和Fe3+的氧化性,特邀你参与以下探究活动。
I.理论预测
该兴趣小组实验实施前进行了充分的讨论交流,确定选择SO2和FeCl3溶液的反应来探究,并预测将SO2通入FeCl3溶液中的现象。小组同学想听听你的
(1)确定选择SO2和FeCl3溶液的反应而不选择SO2和Fe(NO3)3溶液的反应来探究,你认为可能是基于什么原因作出的选择:_______________________________________。
(2)将SO2通入FeCl3溶液中,你认为可能观察到的现象是:______________________,你预测的理论依据是(用离子方程式表示):___________________________________。
II.实验探究
(1)配制1mol·L-1FeCl3溶液(未用盐酸酸化)
①下面是小组四位同学在配制溶液时的“转移”操作,其中正确的是:_________。
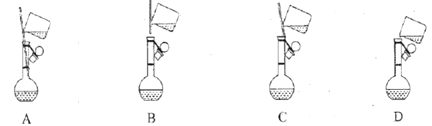
②检测得知溶液呈酸性,其原因是:___________________________(用离子方程式表示)。
(2)将SO2通入FeCl3溶液至饱和,观察到溶液由棕黄色变为红棕色,并没有观察到预期的现象。将反应后的溶液放置12小时后又出现了预期的结果。
查阅资料得知:[Fe(HSO3)]2+为红棕色,生成[Fe(HSO3)]2+的反应为可逆反应。请你用化学方程式解释将SO2通入FeCl3溶液至饱和时观察到的现象:_____________________________________。
(3)为了探究如何缩短红棕色变为预期颜色的时间,小组继续探究:另取少量FeCl3溶液,再通入SO2,溶液变为红棕色,加浓HCl酸化,几分钟后变为预期颜色。请你推测小组在实验方案设计中“加浓HCl酸化”的目的是:_____________________________________________________。
-
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装罝如下图所示。请回答:
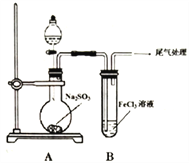
(1)装置A中分液漏斗内的物质是________________ 。
(2)实验时,旋开装置A中分液漏斗的旋塞,发现液体流出缓慢,最终停止,其可能的原因是___________________。
(3)实验过程中通入足量的SO2,请设计一个实验方案,验证SO2与FeCl3溶液反应的主要产物(H+无需检验)______________________________________________。










