-
下列说法正确的是
A.Li是最活泼金属,F是最活泼非金属
B.Mg(OH)2碱性比Ca(OH)2强
C.元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行
D.X2+的核外电子数目为18,则X在第四周期第ⅡA族
难度: 简单查看答案及解析
-
现行元素周期表中已列出112种元素,其中元素种类最多的周期是
A.第4周期 B.第5周期 C.第6周期 D.第7周期
难度: 简单查看答案及解析
-
元素性质呈现周期性变化的基本原因是
A.元素的原子量逐渐增大 B.核外电子排布呈周期性变化
C.核电荷数逐渐增大 D.元素化合价呈周期性变化
难度: 简单查看答案及解析
-
下列叙述中正确的是
A.含有离子键的化合物一定是离子化合物
B.具有共价键的化合物一定是共价化合物
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.化学键是分子中多个原子之间强烈的相互吸引作用
难度: 简单查看答案及解析
-
下列说法正确的是
A. 化学反应中的能量变化都表现为热量变化
B.凡是需要加热后才能发生的反应是吸热反应
C.在稀溶液中,1 mol酸与1 mol碱发生中和反应生成水时所释放的热量称为中和热
D.物质发生化学反应都伴随着能量变化
难度: 简单查看答案及解析
-
短周期元素X、Y、Z在周期表中的位置如图所示,则下列说法正确的是
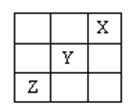
A.X原子最外层电子数最多
B.Y的非金属性比X的非金属性强
C.Z的最高价氧化物的水化物是强碱
D.Z的原子半径大于Y的原子半径
难度: 简单查看答案及解析
-
绿色能源是指使用过程中不排放或排放极少污染物的能源,如一级能源中的水能、地热、天然气等;二级能源中电能、氢能等。下列能源属于绿色能源的是
① 太阳能 ② 风能 ③ 石油 ④ 煤 ⑤ 潮汐能 ⑥ 木材
A.①②③ B.③④⑤ C.④⑤⑥ D.①②⑤
难度: 简单查看答案及解析
-
据报道,1994年12月科学家发现一种新元素,它的原子核内有161个中子,质量数为272。该元素的原子序数为
A.111 B.161 C.272 D.433
难度: 简单查看答案及解析
-
某元素原子最外层上只有两个电子,该元素
A.一定是金属元素
B.一定是ⅡA族元素
C.一定是过渡元素
难度: 简单查看答案及解析
-
有六种微粒,它们分别是:
、
、
、
+、
2+、
-,它们所属元素的种类为
A.3种 B.4种 C.5种 D. 6种
难度: 简单查看答案及解析
-
下列各组化合物中化学键类型不同的是
A.NaCl和HNO3 B.H2O和 NH3 C.MgF2和 NaCl D.H2O和CO2
难度: 简单查看答案及解析
-
决定化学反应速率的主要因素是
A.参加反应的物质本身的性质 B.催化剂
C.反应物浓度 D.压强
难度: 简单查看答案及解析
-
下列四种盐酸溶液,均能跟锌片反应,其中最初反应速率最快的是
A.10℃ 3mol/L的盐酸溶液 B.20℃ 2mol/L的盐酸溶液
C.10℃ 4mol/L的盐酸溶液 D.20℃ 4mol/L的盐酸溶液
难度: 简单查看答案及解析
-
下列装置烧杯中盛放的都是稀硫酸,在铜电极上能产生大量气泡的是

难度: 简单查看答案及解析
-
下列物质中属于离子化合物的是
A.H2 B.H2O C.NaOH D.H2S
难度: 简单查看答案及解析
-
美国科学家用某有机分子和球形笼状分子C60制成了“纳米车”,每辆“纳米车”是由一个有机分子和4个C60分子构成。“纳米车”可以用来运输单个的有机分子。下列说法正确的是
A.人们用肉眼可以清晰看到“纳米车”的运动
B.C60分子内只存在共价键
C.C60是一种新型的化合物
D.C60与金刚石互为同位素
难度: 简单查看答案及解析
-
下列反应过程中的能量变化情况符合右图的是
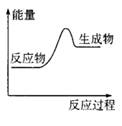
A.镁与盐酸反应
B.生石灰与水反应
C.碳在空气中燃烧
D.氯化铵和氢氧化钡晶体反应
难度: 简单查看答案及解析
-
下列电子式书写正确的是
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列变化是因为原电池反应而引起的是
A.在空气中金属铝表面迅速氧化形成保护膜
B.常温下,铁被浓硫酸“钝化”形成保护膜
C.在潮湿的空气中钢铁易生锈
D.在潮湿的空气中过氧化钠易变质
难度: 简单查看答案及解析
-
“摇摇冰”是一种即用即饮的饮料。吸食时,将饮料罐隔离层中的化学物质和水混合后摇动即会制冷。该化学物质是
A.氯化钠 B.固体硝酸铵 C.生石灰 D.蔗糖
难度: 简单查看答案及解析
-
下列反应既属于氧化还原反应,又是放热反应的是
A.氢氧化钠与稀硫酸的反应
B.灼热的木炭与CO2的反应
C.甲烷在空气中燃烧的反应
D.Ba(OH)2•8H2O晶体与NH4Cl晶体的反应
难度: 简单查看答案及解析
-
下列关于元素周期表和元素周期律的说法错误的是
A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多
B.第二周期元素从Li到F,非金属性逐渐增强
C.卤素随核电荷数增加氢化物越来越稳定
D.O与S为同主族元素,且O比S的非金属性强
难度: 简单查看答案及解析
-
下列关于如图所示装置的叙述中正确的是
A.可将电能转化为化学能 B.铜是正极,铜片上有气泡产生
C.电流从锌片经导线流向铜片 D.氢离子在锌片表面被还原
难度: 简单查看答案及解析
-
下列反应中,生成物的总能量高于反应物的总能量的是
① 液态水汽化;② 将胆矾加热变为白色粉末;③ 浓硫酸稀释;④ 氯酸钾分解制氧气;⑤ 生石灰跟水反应生成熟石灰
A.①④ B.②③ C.①④⑤ D.②④
难度: 简单查看答案及解析
-
铁在下列情况下腐蚀最快的是
A.铁放入海水中 B.将铁置于干燥的空气中
C.将铁和锌连接后放入到淡水中 D.将铁和铜连接后放入到海水中
难度: 简单查看答案及解析
-
下列措施能够减缓反应速率的是
A.将铜与稀硝酸反应的试管浸入热水
B.夏天将牛奶放入冰箱冷藏防止变质
C.将石灰石研碎后与稀盐酸反应制取二氧化碳
D.增大2A(g)+B(g)
3C(g)+4D(g)体系中A的浓度
难度: 简单查看答案及解析
-
下列各组元素性质的递变情况中,错误的是
A.Li、Be、B原子的最高正价依次增大
B.P、S、Cl元素的最高价氧化物对应水化物的酸性依次增强
C.B、C、N、O、F的原子半径依次增大
D.Li、Na、K、Rb元素的金属性依次增强
难度: 简单查看答案及解析
-
X、Y、Z为同周期的三种元素。已知它们最高价氧化物的水化物的酸性由强到弱顺序为HXO4>H2YO4>H3ZO4,则下列判断正确的是
A.非金属性X<Y<Z B.原子半径X>Y>Z
C.气态氢化物的稳定性X>Y>Z D.原子最外层电子数X<Y<Z
难度: 简单查看答案及解析
-
已知反应X+Y=M+N为吸热反应,对这个反应的下列说法中正确的是
A.X的能量一定低于M的能量,Y的能量一定低于N的能量
B.因为该反应为吸热反应,故一定要加热反应才能进行
C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
D.X和Y的总能量一定低于M和N的总能量
难度: 简单查看答案及解析
-
各组性质比较的表示中,正确的是 ( )。
A.酸性:HI < HBr < HCl < HF B.稳定性:HF< HCl < HBr < HI
C.氧化性:F2 < Cl2 < Br2 < I2 D.沸点:F2 < Cl2 < Br2 < I2
难度: 简单查看答案及解析
-
下列用电子式表示的形成过程正确的是
A.
B.
C.
D.
难度: 简单查看答案及解析
-
有下列物质:① NaOH固体;② 浓硫酸;③ NH4NO3晶体;④ CaO固体。现将它们分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内的滴有红墨水的水面呈形如右图所示状态,判断加入的物质可能是

A.① ② ③ ④ B.① ② ④
C.② ③ ④ D.① ② ③
难度: 简单查看答案及解析
-
某原电池总反应离子方程式为Mg + 2H+ = Mg2++H2↑能实现该反应的原电池是
A.正极为铜,负极为镁,电解质溶液为稀盐酸
B.正极为铜,负极为铁,电解质溶液为稀硫酸
C.正极为石墨,负极为镁,电解质溶液为CuSO4溶液
D.正极为银,负极为镁,电解质溶液为NaCl溶液
难度: 简单查看答案及解析
-
有A、B、C、D四块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀硫酸中,A极为负极;②C、D用导线相连后,同时浸入稀硫酸中,电流由D→导线→C;
③B、C相连后,同时浸入稀硫酸中,C极产生大量气泡;④B、D相连后,同时浸入稀硫酸中,D极产生大量气泡。据此,判断四种金属的活动性顺序是
A.A>B>C>D B.A>C>D>B
C.C>A>B>D D.B>D>C>A
难度: 简单查看答案及解析
-
100ml2mol/L的稀硫酸与过量的锌反应,为加快反应速率,又不影响氢气的总量,可采用的方法是
A.不用稀硫酸,改用98﹪浓硫酸 B.加入数滴氯化铜溶液
C.加入适量的蒸馏水 D.加入更多锌片
难度: 简单查看答案及解析
-
第29届奥运会期间,作为马拉松领跑车和电视拍摄车的汽车,装着“绿色心脏”——质子交换膜燃料电池,其工作原理如图所示。下列叙述中正确的是
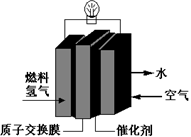
A.通入空气的电极发生氧化反应
B.通入氢气的电极为正极
C.正极的电极反应式为:O2+4H+-4e-==2H2O

 D.总反应式为:O2+2H2==2H2O
D.总反应式为:O2+2H2==2H2O难度: 简单查看答案及解析
-
在N2+3H2
2NH3反应中,自反应开始至2s末,氨的浓度由0变为0.4 mol·L-1,则以氢气的浓度变化表示该反应在2s内的平均反应速率是
A.0.3 mol·L-1·s-1 B.0.4 mol·L-1·s-1
C.0.6 mol·L-1·s-1 D.0.8 mol·L-1·s-1
难度: 简单查看答案及解析
-
在恒温恒容的容器中进行反应A(g)
2B(g)+C(g),若反应物浓度由0.1mol·L-1降到0.06mol·L-1需20s,那么由0.06 mol·L-1降到0.02mol·L-1,需要反应的时间是
A.等于20s B.等于12s C.大于20s D.小于12s
难度: 简单查看答案及解析
-
一定温度下,可逆反应3X(g)+Y(g)
2Z(g)达到限度的标志是
A.X、Y、Z的浓度相等
B.X的生成速率与Z的生成速率相等
C.X、Y、Z的分子个数比为3:1:2
D.单位时间内生成3n mol X,同时消耗n mol Y
难度: 简单查看答案及解析
-
右图是可逆反应X2 + 3Y2
2Z2 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是
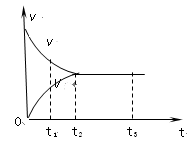
A.t1时,只有正方向反应
B.t2时,反应达到平衡
C.t2- t3,反应不再发生
D.t2- t3,各物质的浓度相等
难度: 简单查看答案及解析
-
下表是元素周期表的一部分,请回答有关问题:

(1)最活泼的非金属元素是________(用元素符号或化学式表示,下同);碱性最强的是________,该物质存在的化学键类型是_________
(2)⑤元素与⑧元素形成化合物的电子式是 ________
(3)③⑦⑧三种元素原子半径由小到大的顺序是 ________
(4)将⑤⑥两种单质用导线相连后,同时浸入稀硫酸中,⑥这一极发生________(填“氧化”或“还原”)反应
难度: 简单查看答案及解析
-
在一定温度下,4L密闭容器内存在反应
,其中气体M、气体N的物质的量随时间变化的曲线如图所示:
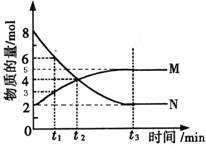
(1)比较
时刻,正逆反应速率大小V正________V逆。
(2)若
=2min,计算反应开始至
时刻,M的平均化学反应速率为:_____________________________。
(3)t1与t2相比,反应速率__________较慢,其原因是__________________;已知该反应是放热反应,则N的能量___________M的能量(填“大于”、“小于”、“等于”)镁条和盐酸的总能量。
难度: 简单查看答案及解析