-
X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质.已知:甲+乙=丁+己,甲+丙=戊+己; 0.1mol•L-1丁溶液的pH为13(25℃).下列说法正确的是( )
A.原子半径:W>Z>Y>X
B.Y元素在周期表中的位置为第三周期第ⅣA族
C.1mol甲与足量的乙完全反应共转移了1mol电子
D.1.0L0.1mol•L-1戊溶液中阴离子总的物质的量小于0.1mol难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.用倾析法分离时,将烧杯中的上层清液用玻璃棒引流到另一容器内,即可使沉淀与清液分离
B.做“钠与水的反应”实验时,切取绿豆大小的金属钠,用滤纸吸干其表面的煤油,放入烧杯中,滴入两滴酚酞溶液,再加入少量水,然后观察并记录实验现象
C.用移液管取液后,将移液管垂直放入稍倾斜的容器中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管
D.一旦金属汞洒落,必须尽可能收集起来,放在水中保存以防挥发;并将硫磺粉撒在洒落的地方,使金属汞转变成不挥发的硫化汞难度: 中等查看答案及解析
-
下列说法正确的是( )
A.油脂、淀粉、蔗糖和葡萄糖在一定条件都能发生水解反应
B.蛋白质是结构复杂的高分子化合物,分子中都含有C、H、O、N四种元素
C.棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O
D.根据分散质粒子的直径大小,分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液与胶体之间难度: 中等查看答案及解析
-
下列实验操作使测定(或配制)结果偏低的是( )
A.测量一包固体的质量,将药品放在右盘,砝码放在左盘
B.中和滴定用的锥形瓶加入少量待测液润洗后,再加待测液
C.在保温容器中测量NaOH和稀盐酸反应的中和热时加入稍过量的NaOH溶液
D.配制一定物质的量浓度的溶液,定容时仰视刻度线难度: 中等查看答案及解析
-
下列各组离子,在溶液中能大量共存,某溶液既能溶解Al(OH)3,又能溶解SiO2的一组是( )
A.K+、Na+、HCO3-、SO42-
B.Na+、NO3-、Cl-、ClO3-
C.H+、Ca2+、CO32-、NO3-
D.Ag+、K+、NO3-、Na+难度: 中等查看答案及解析
-
归纳是一种由特殊(个别)到一般的概括,但是归纳出的规律也要经过实践检验才能决定其是否正确.下面几位同学自己总结出的结论中不正确的是( )
A.不是所有醇都能被氧化成醛,但所有含碳原子大于2的醇都能发生消去反应
B.标准状况下,0.5mol N2和0.5mol O2的混合气体所占的体积约为22.4L
C.原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低
D.反应是吸热还是放热的,必须看反应物和生成物所具有总能量的大小难度: 中等查看答案及解析
-
四支试管分别充满O2、NO2、Cl2、NH3四种气体,把它们分别倒立于盛有下列各种液体的水槽中,发生的现象如图所示,其中充满Cl2的试管是( )
A.
B.
C.
D.难度: 中等查看答案及解析
-
环氧乙烷的化学式为C2H4O,关于环氧乙烷的下列说法正确的是( )
A.它是氧化物
B.它是含有3种元素的混合物
C.它的摩尔质量是44g
D.常温下,1 mol环氧乙烷含有2NA个碳原子难度: 中等查看答案及解析
-
生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧.反应的化学方程式为:
2FeSO4•7H2OFe2O3+SO2↑+SO3↑+14H2O.其中三氧化硫与水蒸气同时冷凝便得到硫酸.用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去).其中b为干燥的试管.下列关于该反应说法正确的是( )

A.若将反应后的三种气体通入BaCl2溶液中,产生的沉淀为BaSO3、BaSO4
B.b中产物用紫色石蕊试液即可检验出其中H+和SO42-
C.为检验反应的另一种生成物,试管c中应加入的试剂为NaOH溶液
D.b中所得到的硫酸的质量分数为29.5%难度: 中等查看答案及解析
-
中学阶段介绍的应用电解法制备的物质主要有三种:一是铝的工业制备、二是氯碱工业、三是金属钠的制备.下列关于这三个工业生产的描述中正确的是( )
A.电解法制金属钠时,负极反应式:Na++e-=Na,
B.电解法生产铝时,需对铝土矿进行提纯,在提纯过程中应用了氧化铝或氢氧化铝的两性
C.在氯碱工业中,电解池中的阴极产生的是 H2,NaOH 在阳极附近产生
D.氯碱工业和金属钠的冶炼都用到了NaCl,在电解时它们的阴极都是 C1一失电子难度: 中等查看答案及解析
-
图是铝热反应(2Al+Fe2O3
Al2O3+2Fe)的实验装置,有关该反应的下列说法中正确的是
( )
A.a 为镁条
B.b为氧化铁与铝粉混合物
C.2mol氧化剂参与反应则电子转移6NA个电子
D.还原剂与氧化产物的物质的量之比为1:2难度: 中等查看答案及解析
-
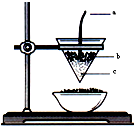
已知电极上每通过96 500C的电量就会有1mol电子发生转移.精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量.实际测量中,常用银电量计,如图所示.下列说法不正确的是( )

A.电量计中的银棒应与电源的正极相连,铂坩埚上发生的电极反应是:Ag++e-=Ag
B.称量电解前后铂坩埚的质量变化,得金属银的沉积量为108.0mg,则电解过程中通过电解池的电量为96.5C
C.实验中,为了避免银溶解过程中可能产生的金属颗粒掉进铂坩埚而导致测量误差,常在银电极附近增加一个收集网袋.若没有收集网袋,测量结果会偏高
D.若要测定电解饱和食盐水时通过的电量,可将该银电量计中的银棒与待测电解池的阳极相连,铂坩埚与电源的负极相连难度: 中等查看答案及解析
-
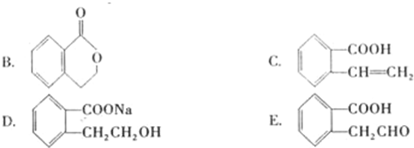
下列说法正确的是( )
A.按系统命名法,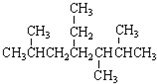 的名称为2,5,6-三甲基-4-乙基庚烷
的名称为2,5,6-三甲基-4-乙基庚烷
B.常压下,正戊烷、异戊烷、新戊烷的沸点依次增大
C.肌醇与葡萄糖
的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物
D.1.0 mol的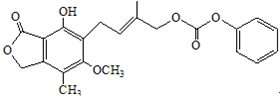 最多能与含5.0 molNaOH的水溶液完全反应
最多能与含5.0 molNaOH的水溶液完全反应 难度: 中等查看答案及解析
-
已知铅+2价稳定,6种物质:H2O、PbO2、Pb(NO3)2、HMnO4、HNO3和Mn(NO3)2可以组成一个化学方程式.下列有关说法正确的是( )
A.反应物中发生氧化反应的物质PbO2
B.被还原的元素是Mn(NO3)2中Mn
C.反应中1mol氧化剂得到5mol电子
D.将反应物配平后的PbO2与Mn(NO3)2系数之比5:2难度: 中等查看答案及解析
-
将51.2g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.9mol,这些气体恰好能被500ml 2mol/L NaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO3的物质的量为( )
A.0.2mol
B.0.4mol
C.0.8mol
D.0.9mol难度: 中等查看答案及解析