-
氧化还原反应广泛应用于金属的冶炼。下列说法不正确的是( )
A.冶炼铁的主要原料有铁矿石、焦炭、空气、石灰石等,其中石灰石的作用是除去铁矿石中的脉石(二氧化硅)
B.湿法炼铜与火法炼铜的反应中,铜元素都发生还原反应
C.工业上Mg可由电解熔融的MgO制取,Na也可由电解熔融的NaCl制取
D.铝热法还原铁的反应中,放出的热量能使铁熔化
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
A.标准状况下,22.4 L SO3含有的分子数为NA
B.常温常压下,1.06 g Na2CO3含有的Na+数目为0.02NA
C.将含1molFeCl3的溶液制得的Fe(OH)3胶体中含胶粒数为NA(假设所有的FeCl3都转化为Fe(OH)3胶体)
D.物质的量浓度为0.5 mol·L-1 MgCl2溶液中,含有Cl-个数为NA
难度: 困难查看答案及解析
-
下列实验可行的是( )
A. 用饱和Na2CO3溶液除去CO2中混有的HCl气体
B. 用量筒量取20.83mL 12mol/L的浓硫酸配制250mL 1mol/L稀硫酸
C. 用浓硫酸干燥CO2、SO2、HI等酸性气体
D. 用稀HNO3能鉴别Mg、Na2CO3、NaAlO2、Na2SiO3四种固体
难度: 中等查看答案及解析
-
ClO2是一种杀菌消毒效率高、二次污染小的水处理剂,实验室中可通过以下反应在制得2KClO3+H2C2O4+H2SO4
2ClO2↑+K2SO4+2CO2↑+2H2O。据此,下列说法不正确的是( )
A.KClO3发生还原反应
B.H2C2O4在反应中被氧化
C.H2C2O4的氧化性强于ClO2的氧化性
D.每生成1 mol ClO2,转移的电子数约为6.02×1023
难度: 中等查看答案及解析
-
Na2O2、Cl2、SO2等均能使品红溶液褪色。下列说法正确的是( )
A.Na2O2、Cl2、SO2依次属于电解质、单质、非电解质
B.Na2O2、Cl2、SO2的漂白原理相同
C.等物质的量的Cl2和SO2同时通入品红溶液,褪色更快
D.在Na2O2中阴、阳离子所含的电子数目相等
难度: 中等查看答案及解析
-
下列化学反应先后顺序判断正确的是( )
A.在含有等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:I—、Br—、Fe2+
B.在含有等物质的量的NaCl、NaBr的溶液中加入硝酸银溶液:Cl—、Br—
C.在含有等物质的量的Fe3+、Cu2+的溶液中加入铁粉:Cu2+、Fe3+
D.在含有等物质的量的H+、Al3+的溶液中,逐滴加入NaOH溶液:H+、Al3+、Al(OH)3
难度: 困难查看答案及解析
-
硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,下列有关说法正确的是( )
A.Na+、Fe3+、K+、ClO— 都可在该物质的溶液中大量共存
B.检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色
C.向0.1 mol·L-1该物质的溶液中逐滴滴加0.1 mol·L-1 NaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如下图所示
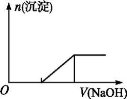
D.向该物质的溶液中滴加Ba(OH)2溶液,恰好使SO42- 完全沉淀的离子方程式为:Fe2++2SO42-+2Ba2++2OH-=2BaSO4↓+Fe(OH)2↓
难度: 中等查看答案及解析