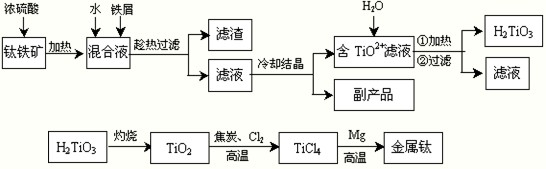
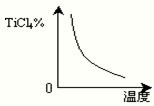
-
以下说法中,不正确的是( )
A.石油的分馏主要是物理变化而煤的干馏主要是化学变化
B.CH2=CH-COOCH3既能够使Br2的四氯化碳溶液褪色,也可使酸性KmnO4溶液褪色
C.淀粉、纤维素的化学式都可表示为(C6H10O5)n,二者互为同分异构体
D.生活中食用的食醋、植物油、动物蛋白等物质者是混合物难度: 中等查看答案及解析
-
生活是化学的源泉,下列有关生活中的化学叙述不正确的是( )
A.铁强化酱油可通过膳食补充人体所需的铁元素
B.不可用铝制餐具长时间存放酸性、碱性食物
C.一定浓度的双氧水可用于伤口的消毒
D.凡含有食品添加剂的食物对人体健康均有害,不宜食用难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A.惰性电极电解500mL饱和食盐水后,若溶液的pH值变为14(假设溶液体积不变),则电极上转移的电子数目为NA
B.在标准状况下,含有NA个分子的三氧化硫的体积约为22.4L
C.1L1mol•L-1的FeCl3溶液中含有Cl-数为3NA
D.9g重水(D2O)中含有的电子数为5NA难度: 中等查看答案及解析
-
常温下,一定能在下列无色溶液中大量共存的离子组是( )
A.c(H+)=1×10-13mol•L-1的溶液:Na+、Ba2+、HCO3-、SO42-
B.在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
C.在能使紫色的石蕊试液变红的溶液中:Na+、NH4+、SO42-、Cl-
D.加入铝单质能产生大量氢气的溶液:Na+、NO3-、SO42-、Cl-难度: 中等查看答案及解析
-
已知:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )
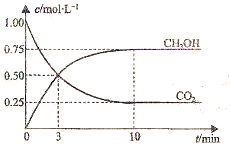
A.升高温度能使增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率υ(H2)=0.075mol•L-1•min-1难度: 中等查看答案及解析
-
根据化学平衡知识,判断下列说法正确的是( )
A.已知NaHA溶液呈弱碱性,则该溶液中下列各种微粒浓度大小排列顺序为:c(Na+)>c(HA-)>c(A2-)>c(H2A)
B.在小苏打溶液中存在下列关系:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
C.向AgCl悬浊液中加入足量的NaI溶液,无明显现象产生
D.常温下,稀释0.1mol/L的氨水,溶液中c(OH-)、c(NH4+)、c(H+)均下降难度: 中等查看答案及解析
-
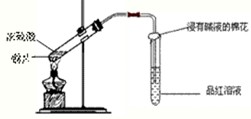
某原电池构造如图所示.下列有关叙述正确的是( )
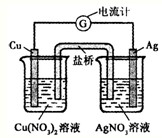
A.在外电路中,电子由银电极流向铜电极
B.取出盐桥后,电流计的指针仍发生偏转
C.外电路中每通过0.1mol电子,铜的质量理论上减小6.4g
D.原电池的总反应式为Cu+2AgNO3=2Ag+Cu(NO3)2难度: 中等查看答案及解析
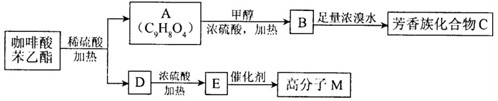
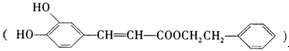 是一种天然抗癌药物,在一定条件下能发生如下转化:
是一种天然抗癌药物,在一定条件下能发生如下转化: