-
已知 A、B、C、D、E 是短周期中原子序数依次增大的 5种主族元素,其中元素 A、E 的单质在常温下呈气态,元素 B 的原子最外层电子数是其电子层数的 2 倍,元素 C 在同周期的主族元素中原子半径最大,元素 D 的合金是日常生活中常用的金属材料.下列说法正确的是( )
A.元素A、B组成的化合物常温下一定呈气态
B.一定条件下,元素C、D的最高价氧化物对应的水化物都是强碱
C.工业上常用电解法制备元素C、D、E的单质
D.化合物AE与CE有相同类型的化学键难度: 中等查看答案及解析
-
下列化学用语正确的是( )
A.14C原子结构示意图: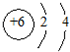
B.硝基苯的结构简式: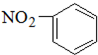
C.NH4Cl的电子式: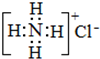
D.FeS2中S的化合价:-2难度: 中等查看答案及解析
-
氯化钠是一种重要的生活、生产必需品.下列叙述中正确的是( )
A.锌粒与盐酸反应时,若加入适量氯化钠晶体,可加快反应速率
B.标准状况下,氯化钠溶液呈中性,溶液的pH=7
C.氯化钠中所含化学键为离子键,含离子键的化合物一定是离子化合物
D.氯化钠溶液导电是化学变化,而熔融态氯化钠导电是物理变化难度: 中等查看答案及解析
-
下列关于有机物的说法中正确的是( )
A.甲苯、葡萄糖和聚丙烯均能使酸性高锰酸钾溶液褪色
B.在鸡蛋白溶液中加入浓Na2SO4溶液,蛋白质的性质会改变并发生变性
C.石油裂解和油脂皂化都有高分子生成小分子的过程
D.分子式为C5H12O属于醇类的同分异构体有8种,一定条件下能被氧化成醛的醇有4种难度: 中等查看答案及解析
-
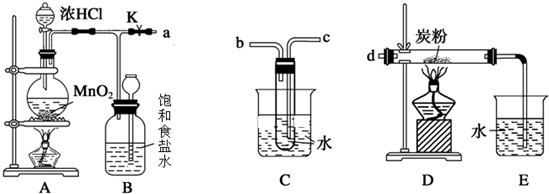
如图装置中,在U形管底部盛有CCl4,分别在U形管两端小心倒入饱和食盐水和稀硫酸溶液,并使a、b两处液面相平,然后分别塞上插有生铁丝的塞子,密封好,放置一段时间后,下列有关叙述中错误的是( )

A.铁丝在两处的腐蚀速率:a<b
B.a、b两处相同的电极反应式为Fe-2e-=Fe2+
C.一段时间后,a处液面高于b处液面
D.生铁丝中的碳在a、b两处分别作原电池的负极和正极难度: 中等查看答案及解析
-
下表中的离子方程式及评价都合理的是( )
编号 化学反应 离子方程式 评 价 A 碳酸钙与醋酸反应 CO32-+2CH3COOH=
CO2↑+H2O+2CH3COO-错误.碳酸钙是弱电解质,不应写成离子形式 B NaHSO3的水解 HSO3-+H2O⇌SO32-+H3O+ 错误.水解方程式误写成电离方程式 C 苯酚钠溶液中通入少量CO2 C6H5O-+CO2+H2O→
CO32-+C6H5OH正确 D 等物质的量的
FeBr2和Cl2反应2Fe2++2Br-+2Cl2=
2Fe3++Br2+4Cl-错误.Fe2+与Br-的物质的量之比与化学式不符
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
X、Y、Z、W均为中学化学中常见物质,一定条件下它们之间有如下转化关系(其它产物已略去):
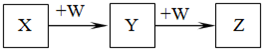
下列说法不正确的是( )
A.若W是强氧化性的单质,则X可能是金属铝
B.若W是氢氧化钠,则X水溶液为酸性
C.若W是单质铁,则Z溶液可能是FeCl2溶液
D.若W是氧气,则X、Z的相对分子质量可能相差14难度: 中等查看答案及解析