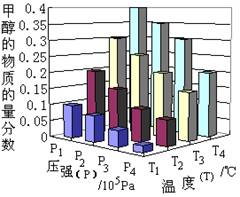
-
华裔科学家高锟发明的光导纤维被称为信息时代的神经。光导纤维属于
A.无机非金属材料 B.金属材料 C.有机高分子材料 D.复合材料
难度: 简单查看答案及解析
-
生活中处处有化学。下列相关表述正确的是
A.天然橡胶的主要成分是异戊二烯
B.通过物理变化将煤气化和液化,能高效清洁地用煤
C.苯酚能用于环境消毒
D.乙醇是不可再生的能源
难度: 简单查看答案及解析
-
化工生产需要用到各种原料,其中与事实相符合的是
A.用乙醇和浓硫酸制乙烯 B.用电解水获得的氢气来合成氨
C.用晒盐后的卤水制溴单质 D.用氢氧化钠和二氧化碳制碳酸钠
难度: 简单查看答案及解析
-
科研、生产、生活中离不开溶液的浓度,相关物质的浓度描述可信的是
A.5mol/L 氢硫酸溶液 B.18.4mol/L 盐酸溶液
C.含甲醛40%的福尔马林溶液 D.含乙酸12%的食醋溶液
难度: 简单查看答案及解析
-
下列化学用语只能用来表示一种微粒的是
A.C3H8 B.
C.二氯乙烷 D.
难度: 简单查看答案及解析
-
油脂在NaOH稀溶液中发生皂化反应,可以判断反应基本完成的现象是
A.反应液使酚酞试液变红色 B.反应液使蓝色石蕊试纸变红色
C.有大量固体析出 D.反应后静置,反应液不分层
难度: 简单查看答案及解析
-
能用键能大小解释的事实是
A.硝酸比磷酸易挥发 B.金刚石的熔点比晶体硅高
C.惰性气体一般很难发生化学反应 D.通常情况下单质溴呈液态、碘呈固态
难度: 简单查看答案及解析
-
某溶液中存在五种离子:NO3-、SO42-、Fe3+、H+和一种未知离子(OH-忽略不计),它们物质的量浓度之比为2:3:1:3:1,则未知离子可能为
A.Fe2+ B.Ba2+ C.C1- D. M g2+
难度: 简单查看答案及解析
-
利用电化学原理保护钢闸门的某装置如图所示,关于该装置的说法正确的是
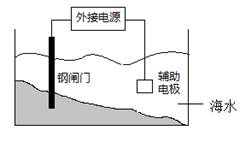
A.钢闸门应与外接电源的负极相连
B.该装置的原理是“牺牲阳极阴极保护法”
C.辅助电极材料可用锌
D.阴极的电极反应式:2Cl--2e→Cl2↑
难度: 简单查看答案及解析
-
按如图实验,反应后可能出现的现象是

铜丝
a
浓硫酸
A.a装置中有白色固体 B.b装置中产生白色沉淀铜丝
C.c装置中溶液先变红后褪色 D.d装置中溶液变蓝色
难度: 简单查看答案及解析
-
任意混合组内溶液,发生的反应均可用离子方程式 Ca2++HCO3-+OH-→CaCO3↓+H2O来表示的是
A.Ca(HCO3) 2(aq)与Ca(OH) 2(aq) B.Ca(HCO3) 2(aq)与NaOH(aq)
C.NaHCO3 (aq)与Ca(OH) 2(aq) D.Mg(HCO3) 2(aq)与NaOH (aq)
难度: 简单查看答案及解析
-
依据有关化学原理推断正确的是
A.常温常压下,弱酸A的浓度小于弱酸B,则A的电离程度一定大于B
B.晶体A易溶于CCl4,则A一定是分子晶体
C.在溶液中单质A能置换出金属B,则单质A可以是金属也可以是非金属
D.能量越低越稳定,故自然界的物质都以能量最低的形态存在
难度: 简单查看答案及解析
-
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)
2NH3(g)+ 92.4 kJ。 实验测得起始、平衡时的有关数据如下表:
容器编号
起始时各物质的物质的量/mol[]
平衡时反应中的能量变化
N2
H2
NH3
①
1
3
0
放出热量a kJ
②
2
3
0
放出热量b kJ
③
2
6
0
放出热量c kJ
下列叙述正确的是
A.反应的平衡常数:③>①>② B.达到平衡时氨气的体积分数:①>③
C.放出的热量(kJ):a<b<92.4 D.反应得到1mol NH3(l),放出热量46.2kJ
难度: 简单查看答案及解析
-
25℃时,Kw =1.0×10-14;100℃时,Kw =5.4×10-13。对有关溶液pH说法正确的是
A.100℃时,pH=12的NaOH(aq)和pH=2的H2SO4(aq)恰好中和,所得溶液的pH=7
B.100℃时,0.2 mol/L Ba(OH)2(aq)和0.2 mol/L HCl(aq)等体积混合,所得溶液的pH=7
C.25℃时,0.2 mol/L NaOH(aq)与0.2 mol/L CH3COOH(aq)恰好中和,所得溶液的pH=7
D.25℃时,pH=12的氨水和pH=2的H2SO4(aq)等体积混合,所得溶液的pH>7
难度: 简单查看答案及解析
-
化学方程式是一种重要的化学用语。所写的化学方程式不能用来正确解释化学过程或事实的是
A.熔融烧碱时不能使用石英坩埚:SiO2 + 2NaOH
Na2SiO3 + H2O
B.在海带灰的浸出液(含有I-)中滴加H2O2得到I2:
2I- +3H2O2 + 2H+ → I2 + O2↑+ 4H2O
C.红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:
3Fe + 4H2O(g)
Fe3O4 + 4H2
D.“84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用时会放出氯气:
ClO-+Cl-+2H+→ Cl2↑+H2O
难度: 简单查看答案及解析
-
β-月桂烯的结构如图所示,一分子该物质与溴发生加成反应,得到的产物(只考虑位置异构)理论上最多有
A.6种 B.7种 C.8种 D.9种
难度: 简单查看答案及解析
-
某化工厂的废水中含1%的H2SO4,采用边排放边处理成化肥硫铵的方法变废为宝(如图所示)。若处理后废水中的硫酸恰好全部转化为硫铵,则所用的20%氨水的流量为

A.1.98×10-3m3/s B.5.49×10-4m3/s C.1.90×10-4 m3/s D.9.52×10-5 m3/s
难度: 简单查看答案及解析
-
室温时,向10mL的醋酸稀溶液中逐滴滴入NaOH稀溶液至过量,有关叙述正确的是
A.实验过程中水的电离程度的变化是先增大后减小
B.当溶液呈中性时,反应恰好完全
C.当反应恰好完全时,消耗NaOH溶液10mL
D.当溶液呈碱性时,其中离子浓度由大到小的顺序可能为c(Na+)>c(OH-)>c(Ac-)>c(H+)
难度: 简单查看答案及解析
-
利用下列实验装置不能完成相应实验的是
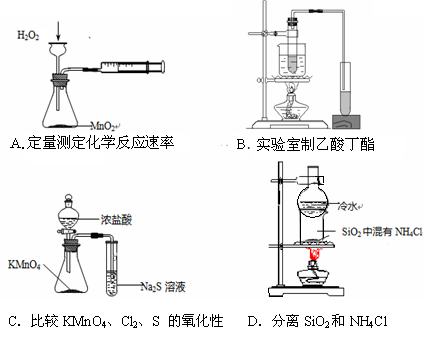
难度: 简单查看答案及解析
-
苯甲醇在热的铜催化下能制得苯甲醛。可用于检验实验所获是否纯净物的方法是
A.定量分析——测沸点 B.定性分析——滴入酸性高锰酸钾溶液
C.定量分析——使用银氨溶液 D.定性分析——与新制氢氧化铜悬浊液共热
难度: 简单查看答案及解析
-
已知硫铁矿(主要成分FeS2)在沸腾炉中煅烧,通入沸腾炉中的气体原料是空气,其中N2的体积分数为0.8,则沸腾炉排出的气体中SO2 的体积分数不可能为
A.0.20 B.0.16 C.0.12 D.0.10
难度: 简单查看答案及解析
-
向FeI2和FeBr2物质的量之比为2:3的混合溶液中逐滴滴入氯水,下列离子反应可能发生的是
A.10Fe2+ + 8I-+4Br-+11Cl2 →10Fe3+ +4I2+2Br2+22Cl-
B.2Fe2+ +2I-+2Cl2 →2Fe3+ +I2+4Cl-
C.6Fe2+ +4I-+5Cl2 →6Fe3+ +2I2+10Cl-
D.6Fe2+ + 2I-+6Br-+7Cl2 →6Fe3+ +I2+3Br2+14Cl-
难度: 简单查看答案及解析