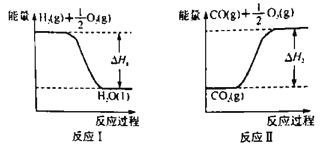
-
把下列4种X的溶液分别加入4个盛有10m L 2 mol·L—1盐酸的烧杯中,均加水稀释到50mL,此时X和盐酸缓慢地进行反应.其中反应速率最大的是( )
A. 20mL 3 mol·L—1的X溶液 B. 20mL 2 mol·L—1的X溶液
C. 10mL 4mol·L—1的X溶液 D. 10mL 2 mol·L—1的X溶液
难度: 简单查看答案及解析
-
下列说法不正确的是
A. 固体煤变为气体燃料后,燃烧效率将提高
B. 化石燃料在燃烧过程中能产生污染环境的CO、SO2等有害气体
C. 直接燃烧煤不如将煤进行深加工后再燃烧的效果好
D. 化石燃料在任何条件下都能充分燃烧
难度: 简单查看答案及解析
-
下列热化学方程式书写正确的是( )
A. S(s)+O2(g)==SO2(g)△H=-296.8kl/mol(反应热)
B. NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)△H=+57.3kl/mol(中和热)
C. C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g) △H=-1367.0kl/mol(燃烧热)
D. 2NO2==O2+2NO △H=+116.2kl/mol(反应热)
难度: 中等查看答案及解析
-
5.6g铁粉投入到足量的100mL2mol/L的稀硫酸中,2min时铁粉刚好溶解,下列表示这个反应的速率正确的是
A. v(Fe)=0.5mol/(L•min) B. v(H2SO4)=1mol/(L•min)
C. v(H2)=0.5mol/(L•min) D. v(FeSO4)=0.5mol/(L•min)
难度: 中等查看答案及解析
-
如图所示,ΔH1=-393.5kJ·mol-1,ΔH2=-395.4kJ·mol-1,
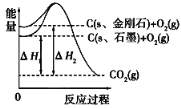
下列说法或表示式正确的是
A.石墨和金刚石的转化是物理变化
B.C(s、石墨)===C(s、金刚石)ΔH =+1.9kJ·mol-1
C.金刚石的稳定性强于石墨
D.断裂1mol石墨的化学键吸收的能量比断裂1mol金刚石的化学键吸收的能量少
难度: 中等查看答案及解析
-
为了测定酸碱反应的中和热,计算时至少需要的数据是
①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应后溶液的质量
⑤生成水的物质的量 ⑥反应前后温度变化 ⑦操作所需的时间
A.①②③⑥ B.①③④⑤ C.③④⑤⑥ D.全部
难度: 中等查看答案及解析
-
在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应:A(s)+3B(g)
2C(g)+D(g)已达化学平衡状态的是
A. 混合气体的压强 B. 混合气体的密度
C. ABCD的分子数之比为1:3:2:1 D. 气体的总物质的量
难度: 中等查看答案及解析
-
在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明平衡移动的
A. 反应混和物的浓度 B. 反应物的转化率
C. 正、逆反应速率 D. 反应混和物的压强
难度: 中等查看答案及解析
-
化学平衡的可逆反应,当改变条件使化学反应向正反应方向移动时,下列叙述正确的是
①生成物的百分含量一定增加 ②生成物的产量一定增加 ③反应物的转化率一定增大 ④反应物的浓度一定降低 ⑤正反应速率一定大于逆反应速率 ⑥使用了合适的催化剂
A. ①② B. ②⑤ C. ③⑤ D. ④⑥
难度: 中等查看答案及解析
-
在一密闭容器中,可逆反应aA(g)
bB(g)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则
A. 平衡向逆反应方向移动了 B. 物质B的质量分数增加了
C. 物质A的转化率减小了 D. a>b
难度: 中等查看答案及解析
-
一定条件下,向5L密闭容器中充入2mol A气体和1mol B气体,发生可逆反应:2A(g)+B(g)
2C(g),达到平衡时容器内B的物质的量浓度为0.1mol/L, A的转化率为
A. 67% B. 50% C. 25% D. 5%
难度: 中等查看答案及解析
-
下列事实中,不能用勒夏特列原理解释的是
A. 开启啤酒后,瓶中马上泛起大量泡沫
B. 钢铁在潮湿的空气中容易生锈
C. 实验室中常用排饱和食盐水的方法收集氯气
D. 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
难度: 简单查看答案及解析
-
向足量H2SO4溶液中加入100mL 0.4mol/L Ba(OH)2溶液,放出的热量使5.12KJ。如果向足量Ba(OH)2溶液中加入100mL 0.4 mol·L-1HCl溶液时,放出的热量为2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为
A. Ba2+(aq)+SO42—(aq)=BaSO4(s);ΔH=-2.92 kJ·mol-1
B. Ba2+(aq)+SO42—(aq)=BaSO4(s);ΔH=-0.72 kJ·mol-1
C. Ba2+(aq)+SO42—(aq)=BaSO4(s);ΔH=-73 kJ·mol-1
D. Ba2+(aq)+SO42—(aq)=BaSO4(s);ΔH=-18 kJ·mol-1
难度: 中等查看答案及解析
-
反应 A+B→C(ΔH<0)分两步进行:①A+B→X (ΔH>0),②X→C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是( )
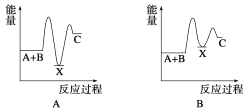

难度: 中等查看答案及解析
-
将V1mL 1.0 mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是

A. 做该实验时环境温度为22 ℃
B. 该实验表明化学能可以转化为热能
C. NaOH溶液的浓度约是1.00 mol/L
D. 该实验表明有水生成的反应都是放热反应
难度: 中等查看答案及解析
-
对于达到平衡的可逆反应:X + Y
W + Z,其他条件不变时,增大压强,正、逆反应速率(υ)变化的情况如图所示。下列对X、Y、W、Z四种物质状态的描述正确的是

A. W、Z均为气体,X、Y中只有一种为气体
B. X、Y均为气体,W、Z中只有一种为气体
C. X、Y或W、Z中均只有一种为气体
D. X、Y均为气体,W、Z均为液体或固体
难度: 简单查看答案及解析
-
amol N2与bmol H2混合,要一定条件下反应达到平衡,生成了cmolNH3,则NH3在平衡体系中质量分数为
A. 17c/(28a+2b-17c)×100% B. 17c/(28a+2b)×100%
C. c/(a+b+c)×100% D. 34c/(28a+2b)×100%
难度: 简单查看答案及解析
-
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,则下列说法正确的是

A.反应的化学方程式为:2M
N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
难度: 中等查看答案及解析
-
可逆反应2M(g)+N(g)
2X(g),下表为M的转化率随温度和压强的变化关系。根据表中的数据可判断选项中图像错误的是
压强\A转化率\温度
p1(MPa)
p2(MPa)
400℃
99.6%
99.7%
500℃
96.9%
97.8%
A.
 B.
B. 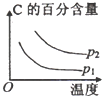 C.
C.  D.
D. 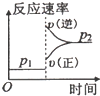
难度: 困难查看答案及解析
-
某温度下,C和H2O(g)在密闭容器里发生下列反应:
①C(s)+H2O(g)
CO(g)+H2(g), ②CO(g)+H2O(g)
CO2(g)+H2(g)
当反应达到平衡时,c(H2)=1.9 mol·L-1,c(CO)=0.1 mol·L-1。则下列叙述正确的有
A.CO在平衡时转化率为10%
B.平衡浓度c(CO2)=c(H2)
C.平衡时气体平均相对分子质量约为23.3
D.其他条件不变时,缩小体积,H2O(g)的转化率随之降低
难度: 困难查看答案及解析
 ΔH=+88.6 kJ·mol-1
ΔH=+88.6 kJ·mol-1