-
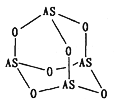
某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3溶液反应也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是 ( )
A. 配合物中中心原子的电荷数和配位数均为6
B. 该配合物可能是平面正方形结构
C. Cl-和NH3分子均与Pt4+配位
D. 配合物中Cl-与Pt4+配位,而NH3分子不配位
难度: 中等查看答案及解析
-
下列对一些实验事实的理论解释正确的是( )
选项
实验事实
理论解释
A
碘单质在CCl4中溶解度比在水中大
CCl4和I2都是非极性分子,
而H2O是极性分子
B
CO2为直线形分子
CO2分子中C═O是极性键
C
金刚石的熔点低于石墨
金刚石是分子晶体,石墨是原子晶体
D
HF的沸点高于HCl
HF的相对分子质量小于HCl
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列各组物质的熔点均与所含化学键的键能有关的是
A. CaO与CO2 B. NaCl与HCl C. SiC与SiO2 D. Cl2与I2
难度: 中等查看答案及解析
-
根据下列性质判断所描述的物质可能属于分子晶体的是( )
A. 熔点1070℃,易溶于水,水溶液能导电
B. 熔点1128℃,沸点4446℃,硬度很大
C. 熔点10.31℃,液态不导电,水溶液能导电
D. 熔点97.81℃,质软,导电,密度0.97g/cm3
难度: 简单查看答案及解析
-
有五种元素X、Y、Z、Q、T。X元素为主族元素,X原子的M层上有两个未成对电子且无空轨道;Y原子的特征电子构型为3d64s2;Z原子的L电子层的p能级上有一个空轨道;Q原子的L电子层的P能级上只有一对成对电子;T原子的M电子层上p轨道半充满。下列叙述不正确的是
A. 元素Y和Q可形成化合物Y2Q3
B. X与T的最高价氧化物对应的水化物,前者的酸性比后者强
C. X和Q结合生成的化合物为离子化合物
D. ZQ2是极性键构成的直线形分子
难度: 困难查看答案及解析
-
下列事实,不能用氢键知识解释的是 ( )
A. 水分子高温下也很稳定
B. 水和乙醇可以完全互溶
C. 冰的密度比液态水的密度小
D. 液态氟化氢的化学式有时可以写成(HF)n的形式
难度: 简单查看答案及解析
-
下列说法错误的是
A. ns电子的能量不一定高于(n-1)p电子的能量
B. 6C的电子排布式1s22s22px2违反了洪特规则
C. 电子排布式(21Sc)1s22s22p63s23p63d3违反了能量最低原理
D. 电子排布式(22Ti)1s22s22p63s23p10违反了泡利原理
难度: 中等查看答案及解析
-
下列现象中所发生的现象与电子的跃迁无关的是
A. 燃放焰火 B. 霓虹灯广告 C. 燃烧蜡烛 D. 平面镜成像
难度: 简单查看答案及解析
-
4p能级只填充一半电子的原子,其原子序数是
A. 15 B. 33 C. 35 D. 51
难度: 中等查看答案及解析
-
下列物质的分子中,键角最大的是( )
A. H2O B. BF3 C. CH4 D. NH3
难度: 中等查看答案及解析
-
下列分子中含有sp2-sp3σ键的是( )
A. CH3CH3 B. CH2=CH-CH=CH2
C. CH≡C-CH3 D. CH2=CH-CH2-CH3
难度: 简单查看答案及解析
-
下列化学式既能表示物质的组成,又能表示物质分子式的是
A. NH4NO3 B. SiO2 C. C6H5NO2 D. Cu
难度: 简单查看答案及解析
-
下列分子中所有原子都满足最外层为8电子结构的是( )
A. BCl3 B. H2O C. SiCl4 D. PCl5
难度: 简单查看答案及解析
-
下列离子中,外层d轨道达半充满状态的是( )
A. Fe3+ B. Cr3+ C. Co3+ D. Cu+
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是 ( )
A. 35Cl和37Cl的原子结构示意图均为
B. HC1O的电子式:
C. CO2的比例模型:
D. HCl的电子式:
难度: 简单查看答案及解析
-
下列对各组物质性质的比较中,正确的是( )
A. 硬度:Li>Na>K
B. 熔点:金刚石>晶体硅>金刚砂
C. 电负性:Na<Al<Mg
D. 空间利用率:体心立方堆积<六方堆积<面心立方堆积
难度: 简单查看答案及解析
-
现代无机化学对硫-氮化合物的研究是最为活跃的领域之一。其中下图是已经合成的最著名的硫-氮化合物的分子结构。下列说法正确的是( )
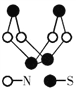
A. 该物质的分子式为SN
B. 该物质的晶体中微粒间作用力有2种
C. 该物质具有很高的熔、沸点
D. 该物质与化合物S2N2互为同素异形体
难度: 中等查看答案及解析
-
下列化合物分子中含2个手性碳原子的是( )
A.
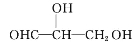 B.
B.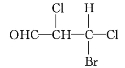
C.
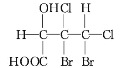 D.
D.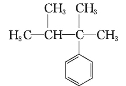
难度: 简单查看答案及解析
-
下列关于晶体和非晶体的本质区别的叙述中,正确的是( )
A. 是否是具有规则几何外形的固体
B. 物理性质是否有各向异性
C. 是否是具有美观对称的外形
D. 内部构成微粒是否在空间呈有规则的重复排列
难度: 简单查看答案及解析
-
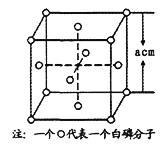
某晶体的一部分如图所示,这种晶体中A、B、C三种粒子数之比是( )
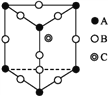
A. 3∶9∶4 B. 1∶4∶2
C. 2∶9∶4 D. 3∶8∶4
难度: 简单查看答案及解析
-
下列变化需克服相同类型作用力的是( )
A. 碘和干冰的升华 B. 硅和C60的熔化
C. 氯化氢和氯化钾的溶解 D. 溴和汞的气化
难度: 中等查看答案及解析
-
已知大多数含氧酸可用通式XOm(OH)n来表示,如X是S,则m =2,n =2,则这个式子就表示H2SO4。一般而言,该式中m大于等于2的是强酸,m为0的是弱酸。下列各含氧酸中酸性最强的是
A. H2SeO3 B. HMnO4 C. H3BO3 D. H3PO4
难度: 中等查看答案及解析
-
下列有关说法不正确是( )
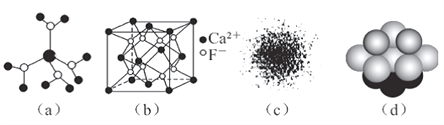
A. 水合铜离子的模型如图(a)所示,1个水合铜离子中有4个配位体
B. CaF2晶体的晶胞如图(b)所示,每个CaF2晶胞平均占有4个Ca2+
C. H原子的电子云图如图(c)所示,H原子核外大多数电子在原子核附近运动
D. 金属Cu中Cu原子堆积模型如图(d),为最密堆积,每个Cu原子的配位数均为12
难度: 简单查看答案及解析