-
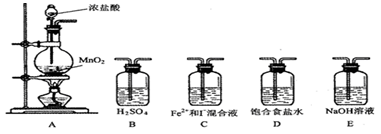
反应①是自海藻灰中提取碘的主要反应,反应②是自智利硝石中提取碘的主要反应:① 2NaI+MnO2+3H2SO4 =2NaHSO4+MnSO4+2H2O+I2
② 2NaIO3+5NaHSO3 =2Na2SO4+3NaHSO4+H2O+I2
已知NaIO3的氧化性与MnO2 相近 ,下列有关说法正确的是
A.I2 在反应①中是还原产物,在反应②中是氧化产物
B.两个反应中生成等量的I2 时转移的电子数相等
C.NaI和NaIO3 在一定条件下能反应生成I2
D.NaIO3 在化学反应中只能做氧化剂不能做还原剂
难度: 中等查看答案及解析
-
在给定条件下,下列加点的物质在化学反应中完全消耗的是
A.用50mL 12mol/L的氯化氢水溶液与足量二氧化锰共热制取氯气
B.向100mL 3mol/L的硝酸中加入5.6g铁
C.标准状况下,将1g铝片投入20mL 18.4mol/L的硫酸中
D.在5×107Pa、500℃和铁触媒催化的条件下,1mol氮气和3mol氢气反应
难度: 简单查看答案及解析
-
绿色化学是从源头上防止污染产生或将化学过程对环境的负面影响降低到最低限度的化学。不仅化工生产应遵循绿色化学的原则,化学实验也应遵循绿色化学原则,实现原料和过程的绿色化。下列实验或实验过程遵循绿色化学原则的是
A.用过量的氯气进行性质实验 B.用双氧水代替高锰酸钾制氧气
C.用溴水代替碘水进行萃取实验 D.用铜粉代替铜丝进行Cu和浓HNO3的反应
难度: 中等查看答案及解析
-
下列物质的电子式书写正确的是
A.NaCl
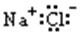
B.H2S
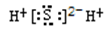
C.-CH3
D.NH4I
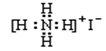
难度: 中等查看答案及解析
-
下列实验过程中,始终无明显现象的是:
A.NO2通入FeSO4溶液中 B.CO2通入CaCl2溶液中
C.NH3通入AlCl3溶液中 D.SO2通入已酸化的Ba (NO3) 2溶液中
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述不正确的是
A.36g镁在足量的氮气中完全燃烧共转移的电子数为3NA
B.室温下,21.0g乙烯和丁烯的混合气体中含有的碳氢键数目为3NA
C.标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为2NA
D.1 molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA
难度: 中等查看答案及解析
-
可以验证硫元素的非金属性比氯元素弱的事实是
①H2S水溶液是弱酸,HCl水溶液是强酸 ②向氢硫酸溶液中滴入氯水有单质硫生成
③硫、氯气分别与铜和铁反应,其产物是FeS、Cu2S、FeCl3、CuCl2
④高氯酸(HClO4)的酸性比硫酸强
A.①②④ B.②④ C.②③④ D.①②③④
难度: 中等查看答案及解析
-
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期, Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是
A.X、M两种元素只能形成X2M型化合物
B.由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低
C.元素Y、Z、W的单质晶体属于同种类型的晶体
D.元素W和M的某些单质可作为水处理中的消毒剂
难度: 中等查看答案及解析
-
某镁铝合金中,镁与铝物质的量之比为1:1,将两份质量相等的镁铝合金分别与足量的盐酸、NaOH溶液反应,生成气体的物质的量之比为
A.5:3 B.1:2 C.3:5 D. 2:3
难度: 中等查看答案及解析
-
下列溶液中一定能大量共存的离子组是
A.含有大量Al3+的溶液:Na+、NH
、SO
、Cl-
B.pH=1的溶液:Na+、K+、SO
、CO
C.含有大量Fe3+的溶液:Na+、Mg2+、NO
、SCN-
D.含有大量NO
的溶液:H+、Fe2+、SO
、Cl-
难度: 中等查看答案及解析
-
不用试剂只用试管和滴管不能鉴别下列无色溶液的是
A.碳酸钠溶液和稀硫酸 B.氯化铝溶液和氢氧化钠溶液
C.四羟基合铝酸钠溶液和稀盐酸 D.氯化钡溶液和碳酸钠溶液
难度: 中等查看答案及解析
-
下列实验操作中,错误的是
A. 制取蒸馏水时,为防止烧瓶内产生暴沸现象,应事先向烧瓶中加入几片碎瓷片
B. 测定未知NaOH溶液浓度时,酸式滴定管需用标准酸液润洗2—3次
C. 配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释
D. 燃着的酒精灯不慎碰翻失火,应立即用湿布盖灭
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是
A.足量硫化氢气体通入硫酸铁溶液中:H2S+Fe3+
Fe2++S↓+2H+
B.足量铁与稀硝酸反应:3Fe+8H++2NO3–
3Fe2++4H2O+2NO↑
C.醋酸溶液与纯碱反应:CO32–+2H+
H2O+CO2↑
D.等物质的量的Ba(OH)2与NaHSO4在溶液中反应:
Ba2++2OH–+2H++SO42–
BaSO4↓+2H2O
难度: 中等查看答案及解析
-
将铝粉与Fe3O4粉末配制成铝热剂,分成三等份。①一份直接放入足量的烧碱溶液中,充分反应后放出气体在标准状况下的体积为V1;②一份在高温下恰好反应完全,反应后的混合物与足量的盐酸反应后,放出的气体在标准状况下的体积为V2;③一份直接放入足量的盐酸中,充分反应后放出气体在标准状况下的体积为V3.下列说法正确的是
A.V1=V3>V2 B.V2 >V1 =V3 C.V1= V2>V3 D.V1>V3>V2
难度: 中等查看答案及解析
-
有五个系列同族元素的物质,101.3 kP时测定它们的沸点(℃)如下表所示:
①
He -268.8
(a) -249.5
Ar -185.8
Kr -151.7
②
F2 -187.0
Cl2 -33.6
(b) 58.7
I2 184.0
③
(c) 19.4
HCl -84.0
HBr -67.0
HI -35.3
④
H2O 100.0
H2S -60.2
(d) -42.0
H2Te -1.8
⑤
CH4 -161.0
SiH4 -112.0
GeH4 -90.0
(e) -52.0
对应表中内容,下列各项中不正确的是
A.a、b、c的化学式分别为Ne、Br2、HF
B.上表内物质HF和H2O,由于氢键的影响,其沸点比同族相应的氢化物要高。
C.系列④中各化合物的稳定性顺序为:H2O>H2S>H2Se>H2Te
D.系列②物质均有氧化性;系列③物质对应水溶液均是强酸
难度: 中等查看答案及解析
-
“类推”的思维方式在化学学习与研究中经常采用,但是有时会产生错误结论。下列类推结论中,正确的是
A.Fe2O3和硝酸反应生成Fe(NO3)3和水,所以FeO和硝酸反应生成Fe(NO3)2和水
B.由
中阳离子与阴离子的个数比为2:1,可推出
中阳离子与阴离子的个数比为2:1
C.由
 反应可推出
反应可推出反应也能发生
D.FeBr2与少量Cl2反应的离子方程式为Fe2+ + Cl2 == Fe3+ +2Cl-,可推出FeI2与少量Cl2反应的离子方程式也为Fe2+ + Cl2 == Fe3+ +2Cl-。
难度: 中等查看答案及解析
-
向Fe2O3、CuO、Fe、Cu的混和粉末中加入过量的稀硫酸,充分反应后,仍有红色粉末存在,则关于溶液中阳离子的判断正确的是
A.只有Fe2+和Cu2+ B.一定有Fe2+、Cu2+,可能有Fe3+
C. 一定有Fe2+,可能有Cu2+ D.只有Fe2+
难度: 中等查看答案及解析
-
水热法制备Fe3O4纳米颗粒的反应为3Fe2+ +2S2O32-+O2 +xOH-=Fe3O4+S4O62-+2H2O,下列说法中不正确的是
A.每生成1mol Fe3O4,反应转移的电子总数为4mol
B.Fe2+和S2O32-都是还原剂
C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol
D.x=4D
难度: 中等查看答案及解析
-
下列实验现象预测正确的是
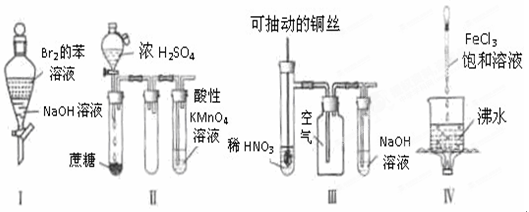
A、实验I:振荡后静置,上层溶液颜色保持不变 浓H2SO4
B、实验II:酸性KMnO4溶液中无气泡,但溶液的颜色逐渐褪去
C、实验III:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D、实验IV:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应
难度: 中等查看答案及解析
-
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果错误的是
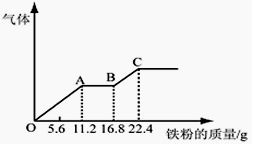
A.原混合酸中NO3-物质的量为0.4mol
B.OA段产生的是NO,AB段的反应为 Fe+2Fe3+=3Fe2+,BC段产生氢气
C.第二份溶液中最终溶质为FeSO4
D. H2SO4浓度为2.5 mol·L-1
难度: 中等查看答案及解析