-
下列反应既是氧化还原反应,又是吸热反应的是( )
A.铝片与稀H2SO4反应
B.Ba(OH)2•8H2O与NH4Cl反应
C.灼热的炭与CO2反应
D.甲烷在O2中的燃烧反应难度: 中等查看答案及解析
-
目前,医疗上使用放射性核素12553I治疗肿瘤,该核素原子核内的中子数与电子数之差是( )
A.19
B.53
C.72
D.125难度: 中等查看答案及解析
-
化学与人类生活、社会可持续发展密切相关.下列措施有利于节能减排、保护环境的是( )
①加快化石燃料的开采与使用;
②研发易降解的生物农药;
③应用高效洁净的能源转换技术;
④田间焚烧秸秆;
⑤推广使用节能环保材料.
A.①③⑤
B.②③⑤
C.①②④
D.②④⑤难度: 中等查看答案及解析
-
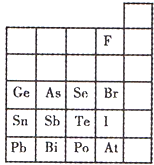
门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确.根据元素周期律,下列有关X性质的描述中错误的是( )
A.X单质不易与水反应
B.XO2可被碳或氢还原为X
C.XCl4的沸点比SiCl4的高
D.XH4的稳定性比SiH4的高难度: 中等查看答案及解析
-
下列排列顺序不正确的是( )
A.热稳定性:H2O>HF>H2S
B.原子半径:Na>Mg>O
C.酸性:HClO4>H2SO4>H3PO4
D.非金属性:F>Cl>Br难度: 中等查看答案及解析
-
下列物质中既有离子键又有共价键的是( )
A.CaCl2
B.H2O
C.K2O
D.NaOH难度: 中等查看答案及解析
-
某同学设计实验从海带中提取碘:①滴加稀硫酸和双氧水;②在海带中加入少量酒精,点燃使其燃烧为灰烬,在灰烬中加水搅拌;③加四氯化碳并振荡;④过滤;⑤分液.该实验的合理操作顺序是( )
A.①③⑤②④
B.②①③④⑤
C.②④①③⑤
D.③①②⑤④难度: 中等查看答案及解析
-
现有三种粒子的结构示意图:
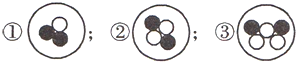
(其中●表示质子,○表示中子).则下列有关这三种粒子的叙述正确的是( )
A.属于不同的元素
B.具有相同的质量数
C.具有不同的核电荷数
D.化学性质相似难度: 中等查看答案及解析
-
化学与生产、生活密切相关.下列叙述正确的是( )
A.煤的干馏和石油的分馏均属于化学变化
B.蛋白质和蔗糖都属于高分子化合物,一定条件下都能水解
C.乙烯的产量是衡量一个国家的石油化工发展水平的标志
D.淀粉与纤维素互为同分异构体难度: 中等查看答案及解析
-
下列说法正确的是( )
A.乙醇和乙酸都存在碳氧双键
B.甲烷和乙烯都可以与氯气反应
C.高锰酸钾可以氧化苯和甲烷
D.乙烯可以与氢气发生加成反应,也可发生自身加聚反应生成聚氯乙烯难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl-
B.稀盐酸与小苏打溶液混合:CO+2H+=CO2↑+H2O
C.鸡蛋壳溶于食醋:CaCO3+2H+=Ca2++CO2↑+H2O
D.AlCl3溶液中加入过量的氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH难度: 中等查看答案及解析
-
下列转化属于取代反应的是( )
A.苯→环已烷
B.乙酸→乙酸乙酯
C.乙烯→乙醇
D.乙醇→乙醛难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.通过加热分解HgO可制得单质Hg
B.炼铁时,还原剂CO将铁从铁矿石中还原出来
C.沙里淘金是利用金和沙子的密度不同,从而将金粒分离出来
D.活泼金属Na、Al的冶炼都是通过电解其氯化物水溶液制得的难度: 中等查看答案及解析
-
参照反应Br+H2⇌HBr+H的能量对反应历程的示意图,下列叙述中正确的是( )
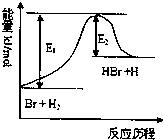
A.正反应为放热反应
B.加入催化剂,该化学反应的反应热变大
C.反应物总能量低于生成物总能量
D.升高温度可增大正反应速率,降低逆反应速率难度: 中等查看答案及解析
-
宇宙飞船上常使用氢氧燃料电池,其电极总反应式为:2H2+O2=2H2O;若电解质溶液为KOH溶液,反应保持在较高温度,使水蒸发,则下列叙述正确的是( )
A.此电池能见到浅蓝色火焰
B.H2为正极,O2为负极
C.工作时电解液中OH-的物质的量不断增加
D.电极反应为:负极H2失电子;正极O2得电子难度: 中等查看答案及解析
-
下列实验或过程符合化学实验“绿色化学”原则的是( )
A.用铜粉代替铜丝进行铜和浓硝酸反应的实验
B.用双氧水代替高锰酸钾制取氧气
C.苯与浓硝酸在高温下反应制取硝基苯
D.用较多量的氯气进行性质实验难度: 中等查看答案及解析
-
下列关于丙二醇(结构简式为HOCH2CH2CH2OH)与二甘醇(结构简式为HOCH2CH2-O-CH2CH2OH)的说法中正确的是( )
A.丙二醇与二甘醇互为同系物
B.丙二醇与二甘醇都能发生氧化反应
C.1 mol丙二醇与二甘醇的混合物可以与足量金属钠反应生成11.2L氢气
D.丙二醇和二甘醇互为同分异构体难度: 中等查看答案及解析
-
酒后驾车是引发交通事故的重要原因.交警对驾驶员进行呼气酒精检测的原理:橙色的K2Cr2O7酸性水溶液遇乙醇迅速生成蓝绿色Cr3+.此过程涉及到的乙醇性质有( )
①乙醇易挥发②乙醇密度比水小③乙醇有还原性 ④乙醇可发生置换反应.
A.①③
B.②③
C.②④
D.①④难度: 中等查看答案及解析
-
在海水的综合利用中,海水提溴工业是一个重要组成部分,其中一种提溴的工艺是在预先浓缩并酸化的海水中,通入足量氯气,然后使生成的溴与吸收剂SO2反应转化为氢溴酸以达到富集溴元素的目的.有关上述工艺流程的以下化学用语中,不正确的是( )
A.海水中Br-的电子式为:
B.海水中通入氯气时发生反应的离子方程式为:2Br-+Cl2=Br2+2Cl-
C.Cl-的结构示意图为: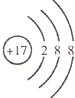
D.SO2吸收溴单质时发生反应的化学方程式为:2H2O+SO2+Br2=H2SO3+2HBr难度: 中等查看答案及解析
-
如图是元素周期表短周期的一部分,A、B两种元素可以形成B2A2分子,分子中所有原子的最外电子层都达到8个电子的稳定结构.下列说法不正确的是( )
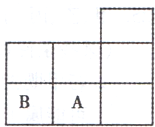
A.A的氢化物的水溶液为强酸
B.该化合物的分子式为S2Cl2
C.该化合物为共价化合物
D.B位于元素周期表第15纵行难度: 中等查看答案及解析
-
对于恒容密闭容器中一定条件下的反应:N2+3H2⇌2NH3,下列说法正确的是( )
A.增加N2的量,可以加快反应速率
B.当N2和H2全部转化为NH3时,反应达到最大限度
C.达到平衡时,H2和NH3的浓度比一定为3:2
D.分别用N2和NH3来表示该反应的速率时,数值大小相同难度: 中等查看答案及解析
-
下列各组反应(表内物质均为反应物)在刚开始时,产生H2速率最快的是( )
编号 金属(粉末状) 物质的量 酸的浓度 酸的体积 反应温度 A Al 0.1mol 18.4mol/L H2SO4 10mL 60℃ B Mg 0.1mol 3mol/L H2SO4 10mL 30℃ C Fe 0.1mol 3mol/L H2SO4 10mL 60℃ D Mg 0.1mol 3mol/L H2SO4 10mL 60℃
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
如图所示装置中,观察到电流计指针偏转;M棒变粗;N棒变细,由此判断表中所列M、N、P物质,其中与实验现象相符的是( )
M N P A Zn Cu NaOH溶液 B Cu Fe 稀盐酸 C Ag Zn AgNO3溶液 D Al Fe CuSO4溶液 
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
某混合物由乙酸和乙酸乙酯两种组分按一定比例组成,其中氢元素的质量分数为
,则该混合物中氧元素的质量分数为( )
A.64%
B.40%
C.72%
D.60%难度: 中等查看答案及解析
-
甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )
A.若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物
B.若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙只能为Na2O2
C.若丙、丁混合产生白烟,且丙为18电子分子,丁为10电子分子,则乙的水溶液可能具有漂白作用
D.若甲、丙、戊含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为:甲<丙<戊难度: 中等查看答案及解析